Восстановление в реальных процессах протекает, как правило, с участием компонентов, находящихся в твердых и жидких растворах. Реакция косвенного восстановления низшего оксида металла при наличии растворов может быть записана в виде
(Ме О) + В газ = [ Ме ] + В Огаз
Здесь указано общепринятое в металлургической литературе обозначение в круглых скобках оксида Ме О в оксидном растворе (шлаке) и обозначение в квадратных скобках металла в металлическом сплаве.
Константа равновесия реакции 
включает активности компонентов в растворах, которые отличаются от единицы и при выборе стандартного состояния «чистый компонент»  ,
,  .
.
Отсюда следует, что равновесный состав газовой смеси В О – В должен зависеть не только от температуры, но и от концентраций растворов.
Рассмотрим изменение условий восстановления на примере реакций восстановления оксидов железа.
Уточненная диаграмма устойчивости железа и его оксидов (см. рис. 8) дает возможность определять условия получения вюстита заданного состава при восстановлении оксидов железа водородом. Удобными для такого же анализа могут оказаться изотермические зависимости в координатах  –
–  . На рис. 9 представлены две изотермы восстановления.
. На рис. 9 представлены две изотермы восстановления.

 Наклонные участки линий соответствуют области гомогенности вюстита. Верхние горизонтали отражают равновесия вюстита с железом. Нижние – равновесия вюстита с магнетитом. Нижняя пунктирная линия указывает на характер изменения равновесной концентрации восстановителя от содержания кислорода в магнетите при 1400 К. Так как состав магнетита при невысоких температурах практически неизменен и соответствует стехиометрическому Fe3O4 (% O = 27,64), то при 1000 К наклонная линия изотермы в области магнетита вырождается в вертикальную.
Наклонные участки линий соответствуют области гомогенности вюстита. Верхние горизонтали отражают равновесия вюстита с железом. Нижние – равновесия вюстита с магнетитом. Нижняя пунктирная линия указывает на характер изменения равновесной концентрации восстановителя от содержания кислорода в магнетите при 1400 К. Так как состав магнетита при невысоких температурах практически неизменен и соответствует стехиометрическому Fe3O4 (% O = 27,64), то при 1000 К наклонная линия изотермы в области магнетита вырождается в вертикальную.
Аналогичная уточненная диаграмма устойчивости железа и его оксидов (см. рис. 10) дает возможность определять условия получения вюстита заданного состава при восстановлении оксидов железа монооксидом углерода.
На рис. 11 в координатах  –
–  представлены две изотермы восстановления. Анализ графиков (рис. 10 и 11) аналогичен выполненному при рассмотрении рис. 8 и 9 в системе Fe – H – O. На графики внесены уточнения в области существования вюстита в системе Fe–С–O, позволяющие определять условия получения вюстита заданного состава при восстановлении оксидов железа монооксидом углерода.
представлены две изотермы восстановления. Анализ графиков (рис. 10 и 11) аналогичен выполненному при рассмотрении рис. 8 и 9 в системе Fe – H – O. На графики внесены уточнения в области существования вюстита в системе Fe–С–O, позволяющие определять условия получения вюстита заданного состава при восстановлении оксидов железа монооксидом углерода.
На рис. 11 в координатах  –
– 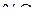 представлены две изотермы восстановления. Анализ графиков (рис. 10 и 11) аналогичен выполненному при рассмотрении рис. 8 и 9 в системе Fe – H – O. На графики внесены уточнения в области существования вюстита в системе Fe – С – O, позволяющие определять условия получения вюстита заданного состава при восстановлении оксидов железа монооксидом углерода.
представлены две изотермы восстановления. Анализ графиков (рис. 10 и 11) аналогичен выполненному при рассмотрении рис. 8 и 9 в системе Fe – H – O. На графики внесены уточнения в области существования вюстита в системе Fe – С – O, позволяющие определять условия получения вюстита заданного состава при восстановлении оксидов железа монооксидом углерода.

 1.8. Восстановление оксидов металлов с образованием металлических
1.8. Восстановление оксидов металлов с образованием металлических
Растворов
Известно, что при восстановлении оксидов углеродом образуются не чистые металлы, а растворы углерода в металлах. Их наличие изменяет условия восстановления.
Если учитывать растворимость углерода в железе, приводящую в конечном счете к образованию железо-углеродистых растворов – стали и чугуна, то изменение условий восстановления железа из FeO можно оценить из анализа рис 12.
Учет образования твердых растворов в системе Fe–C–O приводит к уточнению записи, определяющей равновесный состав газовой смеси CO-CO2 реакции (е)
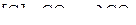 .
. 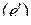
Здесь вместо чистого графита указывается углерод, растворенный в железе.
Тогда константа равновесия данной реакции, по величине не отличающаяся от 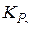 должна быть записана
должна быть записана
 (32)
(32)
где  – активность углерода в растворе железо – углерод.
– активность углерода в растворе железо – углерод.
Известно, что большие различия свойств атомов Fe и C и значительная растворимость С в g- Fe (до 2 %) не позволяют считать раствор Fe – C идеальным и приравнивать  мольной доле
мольной доле  . Так как для ненасыщенных углеродом растворов
. Так как для ненасыщенных углеродом растворов  , то из анализа уравнения (32) следует, что при одних и тех же Р и Т равновесная концентрация СО в газовой фазе при наличии раствора Fe – C должна быть меньше, чем над графитом. Следовательно, изобары (кривые е¢) должны располагаться на диаграмме (рис. 5) ниже кривых е, но сливаться с последними (при одинаковых Р), если растворы становятся насыщенными, то есть когда
, то из анализа уравнения (32) следует, что при одних и тех же Р и Т равновесная концентрация СО в газовой фазе при наличии раствора Fe – C должна быть меньше, чем над графитом. Следовательно, изобары (кривые е¢) должны располагаться на диаграмме (рис. 5) ниже кривых е, но сливаться с последними (при одинаковых Р), если растворы становятся насыщенными, то есть когда  , а из раствора возможно выделение графита.
, а из раствора возможно выделение графита.
Таким образом, для определения условий восстановления железа с растворенным в нем углеродом необходимо знать активности углерода, зависящие от концентрации углерода в растворе и от температуры.
Изобары е¢ на рис. 12 имеют обозначения, соответствующие мол.% С в аустените. Часть кривой е¢ (0,51) представлена пунктиром, так как ниже 1183 К аустенит сосуществует с ферритом – раствором углерода в α-Fe, и зависимость (35) не выполняется. Точка 2 на диаграмме соответствует нормальной температуре начала восстановления FeO твердым углеродом. Диаграмма позволяет предсказывать оптимальные условия (температуру и состав газа) науглероживания железа до заданной концентрации.
 2020-01-14
2020-01-14 297
297








