Восстановление твердых оксидных фаз относится к топохимическим реакциям, протекающим на межфазной границе восстанавливаемого оксида и его продукта. Скорость химических взаимодействий зависит от состояния и размера поверхности раздела фаз.
Механизм и кинетическая схема восстановления металлов
Из оксидов газами
Общепринятые представления о механизме реакций восстановления металлов из их оксидов обобщены в настоящее время в адсорбционно-каталитической теории, предложенной Чуфаровым Г.И. и развитой в работах Ростовцева С.Т., Есина О.А., Гельда П.В. и других ученых. В основе ее лежит положение о первостепенной роли адсорбции в процессах восстановления.
Согласно данной теории механизм восстановления включает три стадии:
1) адсорбцию восстановителя на реакционной поверхности;
2) кристаллохимический акт, включающий переход кислорода решетки оксида к адсорбированным молекулам восстановителя с одновременной перестройкой решетки исходного оксида в решетку продукта восстановления;
3) десорбцию газообразного продукта восстановления.
Этот механизм представляется схемой:
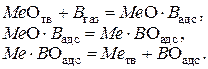
Суммарный процесс соответствует реакции:
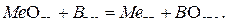
По адсорбционной теории реагируют с оксидами только те молекулы газа-восстановителя, которые адсорбировались на поверхности оксида.
Адсорбция происходит на активных центрах. Идет отрыв атомов (ионов) кислорода от катионов металла, образование адсорбционных комплексов (например, 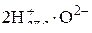 ), из которых формируются молекулы продукта восстановления, десорбирующиеся в газовую фазу.
), из которых формируются молекулы продукта восстановления, десорбирующиеся в газовую фазу.
Потеря кислорода оксидом ведет к образованию пересыщенного твердого раствора низшего оксида в высшем или раствора металла в оксиде при протекании последней ступени восстановления. Такой раствор неустойчив и распадается. Результатом является появление кристаллов новой фазы, которые в дальнейшем растут.
С точки зрения адсорбционно-каталитической теории процесс восстановления является автокаталитическим, т.е. образование твердого продукта реакции приводит к ускорению процесса его образования.
Автокатализ связан с локализацией реакции на границе раздела фаз оксид – твердые продукты восстановления, которая является своеобразным катализатором, возникающим в ходе самого процесса. В условиях, соответствующих кинетическому режиму процесса, как правило, при восстановлении наблюдается характерный для автокатализа максимум скорости на определенном этапе восстановления. Типичные кинетические зависимости изменения скорости процесса 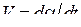 и изменения степени восстановления
и изменения степени восстановления 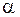 во времени t приведены на рис. 16. Как видно, можно выделить три периода, характерных для топохимических реакций:
во времени t приведены на рис. 16. Как видно, можно выделить три периода, характерных для топохимических реакций:
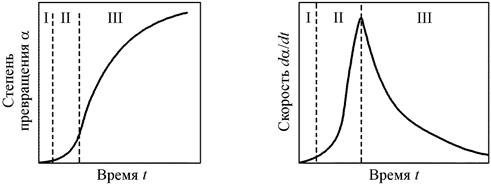
Рис. 16. Кинетика топохимических реакций
I – индукционный период, характеризующийся малыми скоростями процесса, связанными с трудностями зарождения новой фазы;
II – автокатализ, связанный с ускорением реакции из-за постоянно увеличивающейся поверхности раздела двух твердых фаз и деформацией сопрягающихся решеток фаз;
III – период замедления процесса; уменьшение скорости связано с уменьшением количества старой фазы и поверхности раздела.
Следует отметить, что при отсутствии торможений в зарождении новой фазы I и II периоды могут отсутствовать.
С кинетической точки зрения восстановление оксидов газами является сложным гетерогенным процессом, включающим следующие стадии:
1) подвод восстановителя из ядра газового потока к наружной поверхности восстанавливаемого оксида; это этап внешней диффузии, или внешней массопередачи;
2) диффузия восстановителя к реакционной зоне через макро- и микропоры, дефекты решетки слоя твердого продукта восстановления; это этап внутренней диффузии или внутренней массопередачи;
3) собственно химическая реакция восстановления с кристаллохимическим превращением исходного оксида в низший или металл (по адсорбционно-каталитическому механизму);
4) отвод газообразных продуктов восстановления в газовый поток путем внутренней и внешней массопередачи.
Из этой схемы следует, что восстановление является совокупностью двух видов процессов:
– взаимодействия газов с оксидами на реакционной поверхности;
– диффузии газов между ядром потока и реакционной поверхностью.
В зависимости от того, какой из этих процессов протекает наиболее медленно (является лимитирующим), наблюдается:
– либо неодинаковое влияние одних и тех же факторов на скорость восстановления;
– или отсутствие влияние некоторых из них в определенных условиях.
Различное соотношение скоростей диффузии и реакции восстановления приводит к двум типам восстановления: ступенчатому и зональному.
Ступенчатость и зональность являются проявлением справедливости принципа последовательности превращений А. А. Байкова, который для системы Fe–O представляется схемой (при T > 570 °C):
Fe2O3 ® Fe3O4 ® FeO ® Fe.
При ступенчатом типе восстановления наблюдается строгая повременная последовательность в смене отдельных ступеней восстановления во всем объеме куска (зерна) оксида. Это означает: если обеспечить свободную доставку восстановителя в любой участок зерна восстанавливаемого оксида, например, Fe2O3, то все зерно Fe2O3 вначале превратится в Fe3O4, затем в FeO и только после этого появится Fe.
При зональном типе восстановления наблюдается пространственное разделение ступеней восстановления. Это означает: если кусок (зерно) Fe2O3 подвергнуть восстановлению в условиях затрудненной диффузии газов, то в какой-то момент времени частично восстановленный гематит окажется состоящим из зон, соответствующих отдельным ступеням восстановления. При этом на поверхности куска может быть железо, под ним зоны FeO и Fe3O4; внутри сохраняется ядро Fe2O3. Границы зон по ходу восстановления, по мере обеспечения их необходимым количеством восстановителя продвигаются друг за другом к центру куска.
Таким образом:
Ступенчатый тип процесса характерен для кинетического режима и реализуется при измельченном материале, находящемся во взвешенном состоянии в газовом потоке, или при наличии высокопористого оксида.
Зональный характер восстановления наблюдается при восстановлении плотных материалов в условиях диффузионного режима. В реальных условиях идеальное расположение зон может быть нарушено вследствие разного рода макродефектов (трещины, поры и др.), имеющихся в рудных материалах, по которым газ может диффундировать внутрь оксида. При этом получается “размытая” (вплоть до центра зерна) реакционная зона.
Следует иметь в виду, что при сопоставимых скоростях реакции восстановления и диффузии процесс может идти в смешанном (переходном) режиме, или диффузионно-кинетическом режиме. Именно в этом режиме процесс характеризуется наиболее сложными кинетическими закономерностями.
 2020-01-14
2020-01-14 325
325








