Окисление примесей [Ме] из железа, находящегося под окислительным шлаком, можно представить общей реакцией:
m [Me] + n (FeO) = (Me m O n) + n [Fe], (1)
константа равновесия которой
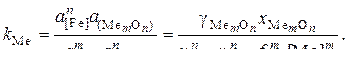 (2)
(2)
Здесь и в дальнейшем для примесей в железе, их оксидов и оксида железа в шлаке выбираем различные стандартные состояния:
· для примесей – 1% раствор, подчиняющийся закону Генри.
Концентрации примесей выражены в мас.%
· для оксидов – чистые компоненты. Концентрации оксидов выражены в мольных долях.
· Активность железа принимаем равной единице.
Реакция (1) относится к окислительно-восстановительным (ОВ).
В соответствии с термодинамическим условием восстановления оксидов, выраженным через их упругость диссоциации, для окисления Ме необходимо выполнение неравенства
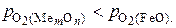 (3)
(3)
Из (3) следует, что для оценки термодинамической возможности окисления различных элементов в металлическом расплаве необходимо сопоставлять величины упругостей диссоциации оксидов этих элементов с упругостью диссоциации FeO.
Упругости диссоциации оксидов существенно зависят от их активностей в шлаке и от активностей продуктов диссоциации в железе.
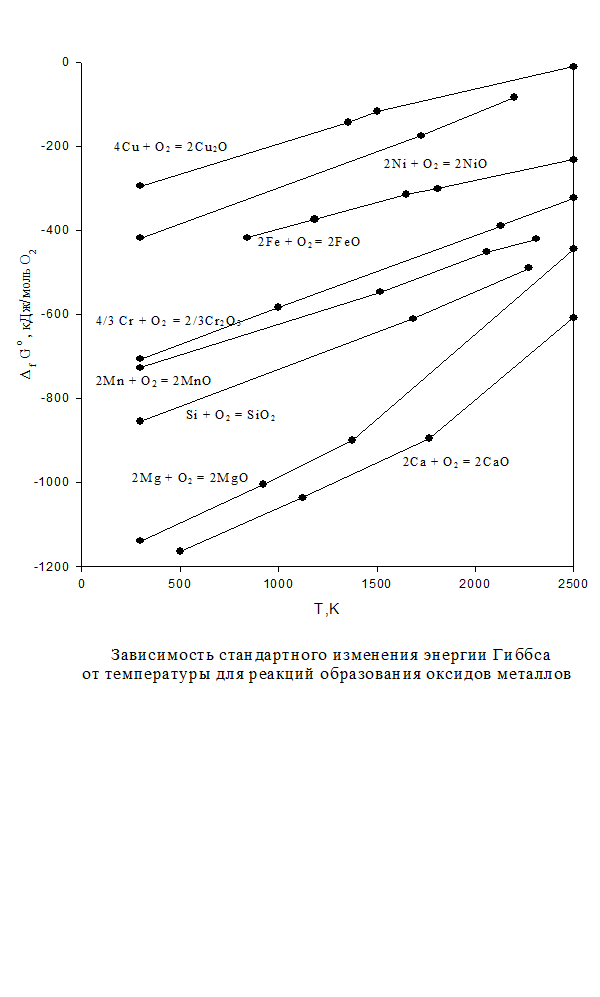
Поэтому для определения условий рафинирования стали часто используют качественные выводы, следующие из сравнения упругостей диссоциации чистых оксидов, значения которых 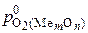 и
и 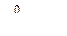 рассчитаны из
рассчитаны из 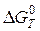 образования оксидов при отсутствии растворов. На рис приведен фрагмент диаграммы устойчивости чистых оксидов, образованных из чистых металлов. На основе приведенных линий можно объяснить следующие факты:
образования оксидов при отсутствии растворов. На рис приведен фрагмент диаграммы устойчивости чистых оксидов, образованных из чистых металлов. На основе приведенных линий можно объяснить следующие факты:
Ca, Mg, Si, Mn, Al, Ti окисляются в сталеплавильном агрегате и тем полнее, чем ниже 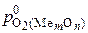 .
.
Ni, Co, Cu, для оксидов которых 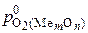 >
>  , не переходят из металла в шлак при производстве стали.
, не переходят из металла в шлак при производстве стали.
Значения упругости диссоциации оксидов в отсутствии растворов 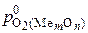 используются и для расчета константы равновесия реакции
используются и для расчета константы равновесия реакции 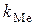 , в котором должен быть учтен переход элемента (Ме) из стандартного состояния “чистый компонент” в стандартное состояние “1% раствор”. Тогда получается уравнение:
, в котором должен быть учтен переход элемента (Ме) из стандартного состояния “чистый компонент” в стандартное состояние “1% раствор”. Тогда получается уравнение:
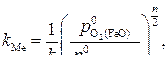 (4)
(4)
где 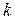 – константа равновесия реакции перехода примеси из чистого состояния в 1% раствор в железе по реакции m Me = m [Me]1%.
– константа равновесия реакции перехода примеси из чистого состояния в 1% раствор в железе по реакции m Me = m [Me]1%.


Знание 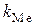 необходимо для строгого определения направления реакции (1) с помощью уравнения изотермы
необходимо для строгого определения направления реакции (1) с помощью уравнения изотермы
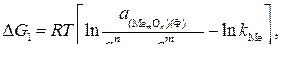 (5)
(5)
Первое слагаемое – отношение фактических активностей реагентов в неравновесных расплавах 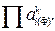
Из уравнения (5) следует, что:
– изменяя активности (фактические концентрации) реагентов в расплавах за счет других, можно в принципе обеспечить неравенство 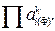 <
< 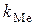 для любого элемента и его окисление.
для любого элемента и его окисление.
Для этого нужно
· увеличивать окислительную способность шлака (обеспечить рост 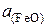 ),
),
· увеличить активность элемента в железе?
· снизить активность его оксида в шлаке.
При малых значениях 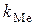 (большом значении
(большом значении 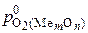 ) достичь выполнения указанного неравенства трудно, в связи с чем на практике для таких элементов, как Ni, Cu и др. оно не реализуется.
) достичь выполнения указанного неравенства трудно, в связи с чем на практике для таких элементов, как Ni, Cu и др. оно не реализуется.
Минимальная остаточная (равновесная) концентрация примеси [Me] после окисления определяется условиями равновесия реакции (1) и ее значение можно найти из уравнения (2).
Часто для характеристики полноты окисления элемента используют коэффициент распределения данного элемента между шлаком и металлом, который записывают в двух вариантах:
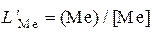 (6а)
(6а)
или 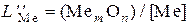 (6б)
(6б)
Вариант (6б) удобен тем, что химический анализ шлака представляет содержание не элементов, а их оксидов.
Коэффициент распределения может быть найден из уравнения (2) после пересчета мольной доли 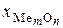 в мас.%.
в мас.%.
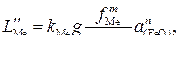 (7)
(7)
где g – фактор пересчета 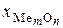 в мас.%.
в мас.%.
Из уравнения (7) следует, что полнота перехода элемента из металла в шлак (коэффициент распределения 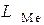 растет), если
растет), если
· увеличивается константа равновесия 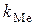 , что может происходить при соответствующем знаку теплового эффекта реакции изменении температуры;
, что может происходить при соответствующем знаку теплового эффекта реакции изменении температуры;
· меньше упругость диссоциации оксида элемента и больше его химическое сродство к кислороду;
· увеличивается окислительная способность шлака (рост 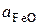 );
);
· уменьшается коэффициент активности 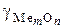 ;
;
· увеличивается 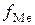 .
.
Влияние последних двух факторов связано с изменением энергетического состояния частиц, содержащих данную примесь в шлаке и в металле, при изменении состава расплавов и температуры.
Уравнения (2) и (7) используются для расчета концентрации [Me],
Они не всегда удобны для анализа влияния состава шлака на равновесную концентрацию примеси в стали.
Более эффективна запись уравнений реакций окисления и соответствующих констант в ионной форме.
Рассмотрим реакции окисления некоторых примесей.
Окисление кремния
Окисление кремния может быть записано в виде реакций:
– в молекулярной форме:
[Si] + 2(FeO) = 2[Fe] + (SiO2), 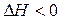 (8)
(8)
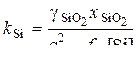 , (9)
, (9)
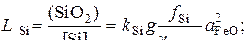 (10)
(10)
– в ионной форме:
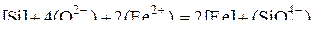 (11)
(11)
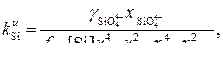 (12)
(12)
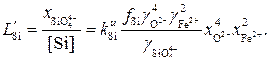 (13)
(13)
Из анализа уравнений (10) и (13) следуют все ранее отмеченные условия более полного окисления кремния из металлического расплава. Можно лишь несколько конкретизировать эти условия, отметив
· положительное влияние понижения температуры, связанное с экзотермичностью реакции окисления кремния;
· сильное положительное влияние концентрации в шлаке свободных ионов О2–, которая возрастает при введении в шлак основных оксидов CaO, MnO, MgO и уменьшается при росте концентрации кислотных оксидов SiO2, P2O5, TiO2;
· положительное влияние уменьшения коэффициента активности частиц, содержащих кремний, в шлаке при повышении содержания CaO в нем за счет образования группировок ионов 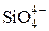 с катионами Са2+.
с катионами Са2+.
Окисление фосфора
Этот процесс в различных формах записи может быть представлен уравнениями:
– в молекулярной форме:
2[P] + 5(FeO) = (P2O5) + 5[Fe],
(P2O5) + 4(CaO) = (4CaO×P2O5), (14)
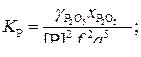 (15)
(15)
– в ионной форме:
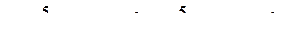 (16)
(16)
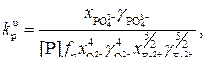 (17
(17
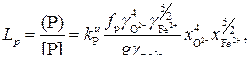 (18)
(18)
где g – фактор пересчета мольной доли фосфора в мас.%.
Из уравнения (18) следует, что для глубокой дефосфорации металла необходимы
· повышенные концентрации в шлаке одновременно ионов железа и кислорода,
то есть оксидов железа и основных оксидов.
Однако, для чисто железистых шлаков коэффициент распределения фосфора 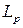 мал, так как мал коэффициент активности ионов кислорода и значителен коэффициент активности частиц, содержащих фосфор, в шлаке.
мал, так как мал коэффициент активности ионов кислорода и значителен коэффициент активности частиц, содержащих фосфор, в шлаке.
Это связано с тем, что слабые ионы 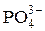 неустойчивы в окружении сильных катионов
неустойчивы в окружении сильных катионов 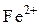 .
.
Повышение их устойчивости в шлаке происходит при наличии в нем слабых катионов, лучше 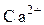 .
.
Поэтому повышение содержания в шлаке CaO способствует дефосфорации металла (в присутствии оксида кальция 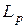 увеличивается в сотни раз). За счет CaO снижается коэффициент активности
увеличивается в сотни раз). За счет CaO снижается коэффициент активности 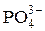 в шлаке и увеличивается активность анионов
в шлаке и увеличивается активность анионов 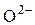 .
.
Таким образом, успешная дефосфорация достигается
· под окислительным и
· под основным шлаком,
· причем для достижения максимального коэффициента распределения 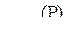 должно быть оптимальное соотношение концентраций CaO и FeO.
должно быть оптимальное соотношение концентраций CaO и FeO.
· при пониженных температурах из-за экзотермичности реакции дефосфорации;
· при наличии в металле элементов, увеличивающих коэффициент активности P в железе f P. Судя по параметрам взаимодействия, это углерод, кремний, кислород.





























Окисление марганца
При окислении марганца образуется основной оксид, что вносит определенные особенности.
Реакция распределения марганца
– в молекулярной форме:
[Mn] + (FeO) = (MnO) + [Fe], 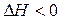 . (19)
. (19)
Константа равновесия и коэффициент распределения имеют вид:
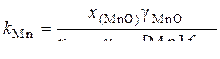 ; (20)
; (20)
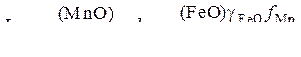 , (21)
, (21)
где g – фактор пересчета мольных долей FeO и MnO в мас.%.
– в ионной форме:
[Mn] + (Fe2+) = (Mn2+) +[Fe], (22)
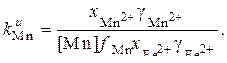 (23)
(23)
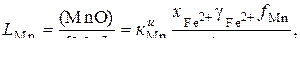 (24)
(24)
где 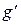 – фактор пересчета мольной доли
– фактор пересчета мольной доли 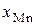 в мас.%.
в мас.%.
Из анализа уравнений следует, что эффективность окисления марганца определяется:
· содержанием FeO (% в шлаке или 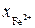 в шлаке)
в шлаке)
· соотношением коэффициентов активности катионов Fe2+ и Mn2+ 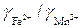 в шлаке.
в шлаке.
· составом металла. Однако коэффициент активности 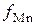 мало отличается от единицы (ввиду близости свойств железа и марганца в металлическом расплаве).
мало отличается от единицы (ввиду близости свойств железа и марганца в металлическом расплаве).
Влияние состава шлака, конкретнее, основности на 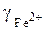 и
и 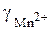 одинаково лишь качественно.
одинаково лишь качественно.
Более крупные по размерам  катионы Mn2+, являясь менее сильными катионами по сравнению с катионами Fe2+, оказываются более устойчивыми в окружении слабых анионов типа
катионы Mn2+, являясь менее сильными катионами по сравнению с катионами Fe2+, оказываются более устойчивыми в окружении слабых анионов типа 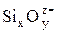 . Поэтому увеличение содержания SiO2 и других оксидов, проявляющих кислотный характер в шлаке, приводит к более полному переходу марганца из металла в шлак.
. Поэтому увеличение содержания SiO2 и других оксидов, проявляющих кислотный характер в шлаке, приводит к более полному переходу марганца из металла в шлак.
Иначе, уменьшение основности шлака приводит к уменьшению коэффициента активности марганца в большей степени, чем 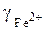 , в связи с чем
, в связи с чем 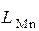 возрастает.
возрастает.
Таким образом, отмечая качественно одинаковое благоприятное влияние понижения температуры, увеличения окислительной способности шлака на полноту окисления Mn, Si, и Р, следует указать на противоположное влияние основности шлака при окислении марганца по сравнению с окислением кремния и фосфора.
 2020-01-14
2020-01-14 284
284








