Под окислительной способностью шлака понимают его способность передавать металлу кислород для окисления примесей.
Эта способность измеряется равновесной концентрацией кислорода в металле [О], находящемся под данным шлаком.
Рассмотрим систему шлак – металл.
Для простоты возьмем шлак, состоящий из CaO, MgO, FeO и SiO2, причем концентрация SiO2 пусть будет небольшой. Учитывая ионную природу шлака, можно считать его состоящим из ионов Ca2 + , Mg2 + , Fe2 + , O2 – и 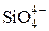 .
.

При контакте шлака с чистым расплавленным железом каждый из ионов стремится частично перейти в металл. Эта тенденция к переходу определяется различием энергий связи частиц в обеих фазах (формально различием активностей).
Хотя энергия связи иона кислорода с металлом достаточно велика, некоторое число ионов О2– может перейти в жидкое железо
(О2–) ® [О] + 2е.
В результате такого перехода с каждым ионом О2– из шлака уходит 2е. Вследствие недостатка отрицательных ионов шлак зарядится положительно, а металл с переходом в него электронов – отрицательно.
Так как в проводниках заряды выталкиваются на поверхность, то на границе металл – шлак появляется двойной электрический слой и связанный с ним скачок потенциала.
Это обстоятельство приводит к быстрому замедлению дальнейшего перехода ионов О2– в металл, и переход кислорода прекратился бы совсем, если бы не шел процесс переноса из шлака в металл катионов Ме2+:
(Ме2+) + 2е ® [Ме].
Этому переходу катионов способствует и расположение зарядов двойного слоя. При избытке положительных зарядов из шлака выталкиваются катионы, которые к тому же притягиваются отрицательно заряженным металлом.
В соответствии с рядом напряжений
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, …., H, Cu, …..
из всех катионов взятого шлака наиболее склонными к восстановлению и переходу в металл оказываются катионы Fe2+ как металла более благородного по сравнению с Ca и Mg.
Поэтому сопровождать переходящие в шлак анионы О2– будут катионы Fe2+:
(Fe2+) + 2e ® [Fe].
В металл будут переходить ионные пары Fe2+ и О2– до установления равновесия:

Итак, окислительная способность шлака зависит от концентрации катионов железа Fe2+, пропорциональной содержанию FeO в шлаке.
При отсутствии в данном шлаке катионов Fe2+ легкоокисляемые элементы Ca и Mg практически не переходят в металл; не должен при этом в металл переходить и кислород.
Поэтому для создания окислительного шлака в практике сталеплавильного производства в шлак вводят железную руду или окалину, т.е. оксиды железа.
Константа равновесия последней реакции:
 (1)
(1)
Так как раствор кислорода в железе является разбавленным, а шлак – ионным раствором, то активности могут быть записаны:
 и
и 
Поэтому
 (2)
(2)
 (3)
(3)
Согласно уравнению (3) равновесная концентрация кислорода в металле определяется
– температурой,
– активностью FeO в шлаке,
– природой и концентрацией примесей в железе, влияющих на величину коэффициента активности кислорода в железе f O.
Активность FeO в шлаке, как и любого компонента, зависит от состава шлака. Иначе, тенденция к переходу О2– и Fe2+ в металл определяется концентрацией других ионов в шлаке, которые с различной силой удерживают ионы О2– и Fe2+ в шлаке.
Присутствие в шлаке таких компонентов как SiO2, P2O5, Al2O3, Cr2O3 и других того же характера приводит к тому, что связь анионов О2– с катионами в оксидном расплаве упрочняется. Вследствие этого даже при постоянной концентрации (FeO) добавление этих оксидов ведет к уменьшению окислительной способности шлака. Это можно объяснить образованием сложных анионов, например:

Введение в шлак основных оксидов СаО, MgO, MnO ведет к увеличению окислительной способности шлака (при неизменной концентрации FeO) из-за увеличения концентрации ионов О2–:

Особенно увеличивает окислительную способность MnO, т.к. катион Mn2+ сопровождает О2– при переходе кислорода из шлака в металл.
Следует иметь в виду, что даже такая качественная оценка влияния изменения состава шлака на его окислительную способность должна быть увязана с природой шлака.
Например, в металле под кислым шлаком при добавке Al2O3 может увеличиваться [O] из-за образования в шлаке новых ионов (О2–):
Al2O3 = 2(AlO+) + (O2–).
При добавлении другого амфотерного оксида Fe2O3 в шлак можно было ожидать уменьшения окислительной способности шлака из-за образования комплексного иона
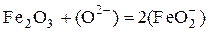 .
.
Однако ионы  как и катионы Fe2+, Mn2+ способствуют уменьшению скачка потенциала на границе шлак – металл по реакции
как и катионы Fe2+, Mn2+ способствуют уменьшению скачка потенциала на границе шлак – металл по реакции


и, в конечном счете, при наличии в шлаке трехвалентного железа (при введении, например, руды, окалины) окислительная способность шлака сильно увеличивается.
Строгая оценка окислительной способности шлака по формуле (3) включает следующие этапы:
– определение а (FeO) для шлака заданного состава по одной из подходящих термодинамических теорий;
– вычисление, обычно с помощью параметров взаимодействия, коэффициента активности f Oв металле, находящемся в равновесии с данным шлаком;
– вычисление при заданной температуре значения константы к Одля реакции
 (4)
(4)
Ведущая роль оксидов железа проявляется и в передаче кислорода из газовой фазы в металл через шлак, когда нет контакта газообразного кислорода с металлом.
С молекулярных позиций схема передачи проста.
На поверхности шлака происходит окисление оксида FeO до Fe2O3 кислородом атмосферы печи. Образовавшийся оксид Fe2O3 затем либо на границе шлак – металл, либо на поверхности корольков железа в шлаке восстанавливается железом до оксида FeO, который остается в шлаке и является поставщиком кислорода в металл.
Учет ионной природы позволяет представить электрохимический характер этих процессов с участием ионов 
Формально же суммарный процесс может быть представлен уравнением
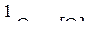 (5)
(5)
Зная константу равновесия этой реакции, состав металла и  газовой атмосферы, можно найти равновесную концентрацию [O] из выражения
газовой атмосферы, можно найти равновесную концентрацию [O] из выражения
 (6)
(6)
В справочной литературе можно найти данные по стандартному изменению энергии Гиббса реакции (5) в виде зависимости:
 , Дж (7)
, Дж (7)
которое справедливо для разбавленных растворов на основе железа.
Для реальных систем с высокой концентрацией примесей в металле расчет f O, а следовательно и [O], весьма усложняется и требует анализа реакций взаимодействия отдельных элементов с кислородом в системе шлак – металл.
Окисление углерода
Реакция окисления углерода является ведущей в процессе окислительного рафинирования жидкой стали.
Скорость обезуглероживания металла в основном определяет производительность сталеплавильного агрегата.
Выделяющийся в виде пузырьков продукт окисления – монооксид углерода интенсивно перемешивает металл и шлак.
За счет этого происходит:
· выравнивание температуры и составов расплавов,
· ускоряются и более полно протекают другие окислительно-восстановительные реакции,
· дегазация металла,
· удаление из металла неметаллических включений.
Реакция обезуглероживания металла:
 (1)
(1)
–Экзотермическая
–Гетерогенная
– Идет на границе расплава с пузырями СО.
Константа равновесия  (2)
(2)
Температурная зависимость имеет вид:  (3)
(3)
Параметры взаимодействия 
 ,
,  ,
, 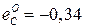 и
и 


[O] – малая величина.
Тогда, если [C] ↑, то f [C] ↑ –увеличивается; f [O] ↓ –уменьшается
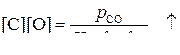 , если [C] ↑ при p CO = const и Т = сonst
, если [C] ↑ при p CO = const и Т = сonst
При небольших концентрациях углерода, [C] < 1%, произведение [C][O] остается практически постоянным [C][O]» const;
Проявляется обратно пропорциональную зависимость между [C] и [O], что иллюстрирует рис., кривая 1.
Из рис. видно, что чем меньше [C], тем выше равновесная концентрация кислорода [O].
Такая же закономерность проявляется и в сталеплавильных агрегатах, где однако фактическая величина концентрации [O]ф выше равновесной (кривая 2).
Следовательно, в производственных условиях металл переокислен по сравнению с равновеесным его состоянием, т.е. реакция окисления углерода не доходит до равнове-
сия. Это означает, что ход процесса и конечные результаты определяются кинетикой процесса.

|
С кинетической точки зрения окисление углерода – сложный гетерогенный процесс. Элементарные стадии:
1) диффузия реагентов – молекулярного кислорода, а затем ионов О2- в шлаке и атомов кислорода в металле, а также атомов углерода в металле, к месту реакции;
2) собственно химическая реакция;
3) образование и удаление газовых пузырей СО.
При температурах сталеварения собственно химическая реакция идет очень быстро. При всех используемых на практике способах доставки кислорода в металл (присадка железной руды, продувка металла кислородом), введенный кислород быстро усваивается.
Скорость окисления углерода увеличивается пропорционально увеличению интенсивности доставки кислорода.
В окислительный период в дуговых печах скорость обезуглероживания характеризуется значениями 0,002 – 0,010 %С/мин, а в кислородном конвертере – 0,2 –0,4 %С/мин.
Это указывает на диффузионный режим процесса обезуглероживания.
Однако и при большой скорости доставки кислорода в металл переокисленность не уменьшается (в то же время существенно и не увеличивается).
Последнее можно объяснить трудностями в образовании новой фазы – пузырьков СО в металле.
Зарождение новой фазы связано с преодолением сил поверхностного натяжения стали, что возможно при определенных степенях химического пересыщения, когда образуется зародыш размером не менее критического.
Из положений теории зарождения новой фазы можно получить выражение для критического размера сферического зародыша пузырька СО в объеме металла:
 (4)
(4)
где s – поверхностное натяжение металла; n – число молей СО в единице объема пузырька;  – химическое пересыщение, равное разности химических потенциалов реагентов реакции окисления углерода.
– химическое пересыщение, равное разности химических потенциалов реагентов реакции окисления углерода.
Величину Dm можно найти из уравнения изотермы реакции

Давление СО в пузырьке Р СО должно складываться из внешнего (атмосферного и гидростатического давления шлака и металла) и капиллярного давления, обусловленного наличием искривленной поверхности, т.е.
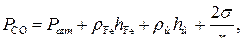 (5)
(5)
где r Fe и rш – плотность металла и шлака; h Fe и hш – толщины слоев металла и шлака; r – радиус пузырька.
При значениях произведения а С ×а О » 5×10–3, характерном для производственных условий, внешнего давления 1,2×105 Па, включающего атмосферное и гидростатическое, и Т = 1900 К величина r кр» 0,01 мм.
Пересчет r кр на содержание в объеме зародыша молекул СО дает величину ~1010 молекул.
Вероятность случайного (в результате флуктуаций) таких больших молекулярных групп в объеме металла практически равна нулю.
Поэтому при обычных концентрациях углерода и кислорода в стали образование зародышей СО в объеме чистого металла невозможно.
Реакция окисления идет на твердых плохо смачиваемых расплавом пористых поверхностях огнеупорных материалов. Имеющиеся в этих материалах сталеплавильного агрегата поры и микропоры с размером поперечного сечения больше критического диаметра пузырька, заполненные обычно газом, играют роль готовых зародышей новой фазы, что, как известно, существенно облегчает процесс зародышеобразования.
Всплывающие пузыри СО являются дополнительными местами протекания реакции, поскольку радиус пузырей больше критического. Металл оказывается пронизанным множеством движущихся пузырей, общий объем которых достигает 2 – 3% от объема металла, и значительная часть углерода окисляется на поверхности всплывающих пузырей. Внешне этот интенсивно протекающий процесс похож на “ кипе-ние ” металла.
Очевидно, что при продувке металла газом (кислородом и инертным газом в кислородном конвертере) еще в большей степени снимаются трудности в зарождении новой фазы, увеличивается скорость окисления углерода.
Однако и в этом случае сохраняется основное положение теории зарождения и роста новой фазы в недрах старой – необходимость пересыщения расплава реагирующими компонентами по сравнению с их равновесными концентрациями. Поэтому в ходе окисления углерода содержание кислорода и углерода оказывается выше равновесных, или, иначе, металл остается переокисленным.
 2020-01-14
2020-01-14 505
505








