Сера, как правило, является вредной примесью в металле.
Полнота десульфурации металла определяется равновесным распределением серы между шлаком и металлом и кинетикой процесса перехода серы в шлак.
Переход серы из металла в шлак по реакции
[S] + 2e = (S2–) (1)
не может протекать без одновременного перехода других ионов, необходимого для компенсации избыточных зарядов на границе металл – шлак.
Реакция (1) является процессом восстановления серы.
Отсюда → вывод о необходимости для успешной десульфурации восстановительных условий, т.е. безокислительного шлака с малым содержанием оксидов железа.
Сопутствующие реакции
(О2–) = [O] + 2e, (2)
(Fe2+) = [Fe] + 2e, (3)
Тогда суммарные уравнения десульфурации металла
[S] + (O2–) = (S2–) + [O], (4)
[Fe] + [S] = (Fe2+) + (S2–). (5)
При молекулярной записи нужно учесть различия в энергиях взаимодействия анионов О2– и S2– с катионами шлака.
Крупные анионы S2– наиболее устойчивы в окружении слабых катионов, представленных в обычном шлаке катионами Са2+ при наличии в нем СаО.
Сильные анионы О2– преимущественно связаны с сильными катионами Fe2+.
Тогда реакции десульфурации могут быть записаны в виде:
[S] + (CaO) = (CaS) + [O], (6)
[FeS] + (CaO) = (FeO) + (CaS). (7)
Вывод.
Удаление серы из металла в шлак идет за счет реагентов, образующих более прочные и существенно менее растворимые, чем FeS, в железе сульфиды CaS, MgS, MnS, Na2S.
Из уравнений (6) и (7) следует, что для смещения равновесия вправо, то есть для более полной десульфурации, необходимо
– увеличивать в шлаке содержание CaO (повышать основность шлака),
– уменьшать содержание FeO (понижать окислительную способность шлака). Иначе, для удаления серы необходим основной восстановительный процесс.
Из уравнений для констант равновесия
 и
и  (8)
(8)
получим выражения для коэффициента распределения серы между шлаком и металлом
 (9)
(9)
где g – коэффициент пересчета 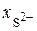 на (S) в мас.%.
на (S) в мас.%.
Выражения (9) позволяют более строго прогнозировать влияние состава шлака на полноту десульфурации, величину L S..
1) Повышение основности при введении CaO и других основных оксидов ведет к увеличению концентрации ионов О2– и  .
.
Однако полнота десульфурации при этом различна.
Так, частичная замена СаО на MnO или MgO ухудшает десульфурацию. Это связано с энергетической неравноценностью катионов Ca2+, Mn2+ и Mg2+.
Иначе, замена слабых катионов Са2+ на более сильные Mn2+ или Mg2+ приводит к усилению взаимодействия катионов с анионами О2– и S2–, причем в большей степени с сильными анионами О2–, чем с S2–. Это проявляетcя в понижении  и
и  . За счет большего уменьшения
. За счет большего уменьшения  по сравнению с
по сравнению с 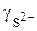 отношение
отношение 
 /
/  уменьшается и падает значение
уменьшается и падает значение  .
.
2) Увеличение содержания SiO2 и других оксидов, связывающих О2– в комплексные ионы, ведет к уменьшению  и
и  .
.
При этом влияние SiO2, Al2O3, P2O5 неодинаково, что также связано с энергетической неравноценностью катионов, образующих оксид. Чем сильнее катион взаимодействует с О2–, тем меньше активность  и меньше полнота перехода серы из металла в шлак.
и меньше полнота перехода серы из металла в шлак.
Вывод о связанном с увеличением  отрицательном влиянии повышения концентрации (FeO) на полноту десульфурации, также вытекает из выражения (9).
отрицательном влиянии повышения концентрации (FeO) на полноту десульфурации, также вытекает из выражения (9).
3) Влияние состава металла на полноту десульфурации металла связано с двумя обстоятельствами:
а) изменением величин коэффициентов активностей  и
и  ;
;
б) изменением состава шлака за счет химических реакций рафинирования и раскисления металла.
Наличие в железе P, Al, а также, что более важно для практики, Si и C, значительно повышающих коэффициент активности серы в металле  , увеличивает
, увеличивает  .. С этим связаны значительно более благоприятные условия десульфурации чугуна по сравнению со сталью.
.. С этим связаны значительно более благоприятные условия десульфурации чугуна по сравнению со сталью.
Марганец, напротив, уменьшает  , что должно приводить к уменьшению
, что должно приводить к уменьшению  . Однако марганец, как Si и Al, является раскислителем (или восстановителем). Понижая концентрацию кислорода в металле [O] и восстанавливая железо из шлака (уменьшая
. Однако марганец, как Si и Al, является раскислителем (или восстановителем). Понижая концентрацию кислорода в металле [O] и восстанавливая железо из шлака (уменьшая  ), марганец, как и другие раскислители, согласно уравнениям (9) способствует более глубокой десульфурации.
), марганец, как и другие раскислители, согласно уравнениям (9) способствует более глубокой десульфурации.
Наличие в металле элементов с меньшим, чем у железа, сродством к кислороду и одновременно слабо влияющих на  , практически не изменяет полноту десульфурации.
, практически не изменяет полноту десульфурации.
4) Данные о влиянии температуры на полноту десульфурации металла противоречивы. Роль температуры следует связывать с кинетикой процесса, которая в производственных условиях определяет результаты десульфурации.
При кинетическом анализе рассматриваемого процесса его можно представить состоящим из следующих стадий:
1. Диффузии атомов серы из объема металла к границе металл – шлак;
2. Собственно электрохимической реакции и перехода образовав-шегося иона S2– в пограничный слой шлака;
3. Диффузии ионов серы в объем шлака;
4. Параллельных процессов диффузии в металле и шлаке и перехода через границу шлак – металл частиц (Fe, Si, Mn, C, O), сопровождающих десульфурацию.
Имеющиеся данные указывают, что собственно реакция протекает достаточно быстро, а лимитирующими стадиями являются диффузионные процессы.
Подтверждением этому служит зависимость скорости десульфурации от перемешивания расплавов, величины поверхности их контакта, вязкости шлака и толщины его слоя.
Если учесть, что вязкость шлака сильно зависит от температуры, то понятно, почему десульфурация стали более эффективна при повышенных температурах.
Влияние указанных факторов и других, связанных с составом шлака и меняющих его свойства, можно выявить из уравнения для скорости десульфурации, полученного методами диффузионной кинетики для гетерогенных процессов:
 , (10)
, (10)
где  – коэффициент диффузии серы в шлаке; Fм–ш – поверхность раздела металл–шлак;
– коэффициент диффузии серы в шлаке; Fм–ш – поверхность раздела металл–шлак;  – толщина непромешиваемого слоя шлака; [S] и (S)V – концентрация серы в металле и объеме шлака;
– толщина непромешиваемого слоя шлака; [S] и (S)V – концентрация серы в металле и объеме шлака;  – коэффициент распределения серы между металлом и шлаком.
– коэффициент распределения серы между металлом и шлаком.
Из уравнения (10) следует:
1. В начале процесса, когда  , можно значением
, можно значением  пренебречь.
пренебречь.
Тогда скорость пропорциональна концентрации  , что соответствует реакции I порядка.
, что соответствует реакции I порядка.
2. Коэффициент диффузии  возрастает с ростом температуры. Значит, при ↑ Т → V ↑.
возрастает с ростом температуры. Значит, при ↑ Т → V ↑.
Это связано и с повышением жидкотекучести или уменьшением вязкости шлака.
По данным Есина и Шихова повышение Т на 60о увеличивает V в 1,1–1,2 раза, но это не связано с термичностью реакции или, иначе, с термодинамическими факторами. Экзотермический тепловой эффект реакции перехода  (хотя и слабый) должен был соответствовать уменьшению
(хотя и слабый) должен был соответствовать уменьшению 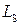 с ростом Т, а напрямую из уравнения (10), и уменьшению скорости V.
с ростом Т, а напрямую из уравнения (10), и уменьшению скорости V.
Раскисление стали
К концу окислительного рафинирования при уменьшении концентрации [C] ниже 0,15 % содержание кислорода в металле резко увеличивается.

Рис. Зависимость [O] от [C] при 1600 0С и Р CO = 1 атм:
1 – равновесные концентрации;
2 – одна из возможных кривых с фактическими
концентрациями
Оно превышает равновесное для реакции обезуглероживания и на несколько порядков выше растворимости кислорода в твердом железе.
Поэтому при кристаллизации такого металла возникают нежелательные явления:
– образование газовых пузырей СО, снижающих плотность слитка;
– выделение по границам зерен металла включений оксидов железа, их растворов с сульфидами и легкоплавких эвтектик (это приводит к красноломкости стали).
Необходимо удаление из жидкой стали избыточного кислорода, что и называют раскислением.
Раскисление можно осуществить тремя способами:
– обрабатывая металл раскислительным шлаком с пониженным содержанием оксидов железа;
– вводя в металл элементы-раскислители;
– снижая парциальное давление СО над металлом.
Эти способы называются:
· Диффузионное раскисление,
· осаждающее раскисление,
· вакуумное раскисление.
При диффузионном раскислении кислород переходит (диффундирует) в шлак,
а при вакуумировании – в виде СО в газовую фазу.
В этих случаях в металле не образуются и не остаются в нем включения, что является основным достоинством этих способов раскисления.
Вместе с тем эти способы требуют:
– наличия либо небольшого количества шлака в агрегате для уменьшения сложностей преобразования его из окислительного в восстановительный,
– либо проведения раскисления в других агрегатах.
Поэтому наиболее распространенным способом раскисления является осаждающее, когда в сталь вводят элементы, обладающие более высоким сродством к кислороду, чем железо (Mn, Si, Al, Ti, Ca и др.).
Соединяясь с кислородом, они создают простые или сложные оксиды, образующие одну или несколько самостоятельных фаз в виде мелкой взвеси, которая из-за малой плотности частично всплывает в шлак, а частично остается в затвердевшем металле в виде неметаллических включений, обычно ухудшающих его качество.
Раскислительная способность элемента определяется равновесной концентрацией кислорода, растворенного в железе, при определенной концентрации этого элемента при данной температуре. Чем меньше [O] при заданном содержании [Me], тем выше раскислительная способность вещества.
Реакцию раскисления можно записать в общем виде:
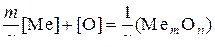 . (1)
. (1)
Константа равновесия реакции  . (2)
. (2)
Отсюда
 . (3)
. (3)
Из уравнения (3) видно, что раскислительная способность элемента определяется его природой (величиной константы равновесия) и температурой.
Значения 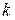 можно найти из известных выражений температурных зависимостей
можно найти из известных выражений температурных зависимостей 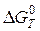 для реакций образования различных оксидов из элементов, растворенных в железе.
для реакций образования различных оксидов из элементов, растворенных в железе.
Чем выше химическое сродство элемента к кислороду, т.е. меньше алгебраическая величина 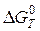 , тем больше
, тем больше 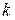 , тем выше раскислительная способность элемента.
, тем выше раскислительная способность элемента.
Из выражений (2) и (3) следует, что с увеличением содержания раскислителя в железе [Me] уменьшается остаточное содержание [O].
Однако такой качественный вывод не всегда верен.
Зависимость  сложна.
сложна.
Ее анализ требует учета, по крайней мере, двух закономерностей.
1. В различных интервалах концентраций [Me] идет образование продуктов раскисления в разных состояниях, или различных продуктов раскисления.
Могут быть
· жидкие растворы оксида раскислителя с другими оксидами (шлак);
· химические соединения (сложные оксиды) – силикаты, алюминаты и другие;
· чистые оксиды, например, корунд Al2O3, кристобалит SiO2 и другие.
Только в последнем случае  ; в других случаях
; в других случаях 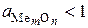 , и это должно приводить к пониженным значениям [O].
, и это должно приводить к пониженным значениям [O].
Отсюда вытекает принципиально разный вид зависимости [O] от [Me] в разных интервалах концентраций [Me].
Отсюда также понятна эффективность использования комплексных раскислителей, таких как силикомарганец, силикокальций и других. При наличии двух-трех элементов-раскислителей в сплаве продукты раскисления, как правило, оказываются в растворе с пониженными активностями, что обусловливает снижение [O] по сравнению с применением каждого элемента-раскислителя в отдельности.
2. Изменение концентрации [Me] приводит к изменению коэффициентов активностей  и
и  . Согласно данным о параметрах взаимодействия
. Согласно данным о параметрах взаимодействия  элементы-раскислители уменьшают
элементы-раскислители уменьшают  , и это должно приводить к увеличению значения [O].
, и это должно приводить к увеличению значения [O].
В связи с двояким влиянием концентрации раскислителя [Me] –
· понижение [O] и
· увеличение [O]
из-за уменьшения  , зависимость [O] от [Me] имеет экстремальный характер с минимумом [O] при определенном для каждого раскислителя значении его концентрации,
, зависимость [O] от [Me] имеет экстремальный характер с минимумом [O] при определенном для каждого раскислителя значении его концентрации,
Выше этого значения с увеличением [Me] наблюдается повышение остаточной концентрации кислорода.
Таким образом, соотношение между 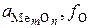 и
и 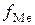 может оказаться решающим, и различие элементов по раскислительной способности может быть иным, чем это следует из простого сравнения химического сродства их к кислороду, определяемого значениями
может оказаться решающим, и различие элементов по раскислительной способности может быть иным, чем это следует из простого сравнения химического сродства их к кислороду, определяемого значениями 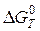 .
.
Результаты раскисления определяются во многом и кинетикой процесса.
С кинетической точки зрения осаждающее раскисление состоит из следующих стадий:
1) растворение раскислителя и равномерное распределение его в объеме металла;
2) химическая реакция;
3) удаление из металла продуктов раскисления.
Химическая реакция между раскислителем и кислородом в расплаве при температурах жидкой стали проходит практически мгновенно.
Поэтому время, необходимое для раскисления, определяется скоростью растворения раскислителя и распределения его в металле. В связи с этим для ускорения процесса раскислители вводят в сталь в виде сплавов, температура начала плавления которых ниже температуры металла. При этом более эффективны раскислители с большой плотностью.
Для продуктов раскисления – оксидов, напротив, желательна меньшая плотность. Такие продукты раскисления быстрее всплывают в шлак. Для оценки скорости всплывания сферических частиц малого размера в неподвижной среде можно использовать формулу Стокса:
 , (4)
, (4)
где g – ускорение силы тяжести,  – коэффициент динамической вязкос-ти среды (расплавленной стали); r – радиус частиц;
– коэффициент динамической вязкос-ти среды (расплавленной стали); r – радиус частиц;  – плотности металла (стали) и частиц (неметаллических включений).
– плотности металла (стали) и частиц (неметаллических включений).
Формула показывает, что повышение температуры стали, ведущее к снижению ее вязкости, должно ускорять удаление неметаллических включений в шлак.
Основными же факторами, определяющими скорость подъема частиц, являются размер и форма неметаллических включений. В момент своего образования продукты реакции – зародыши новой фазы имеют весьма малые размеры. Затем происходит их укрупнение вследствие коалесценции (слияния капелек) и коагуляции (слипания мельчайших кристалликов). Слипание твердых частиц имеет небольшое развитие. Жидкие частицы укрупняются несравненно быстрее и поэтому, имея большие размеры и сферическую (глобулярную) форму, быстро удаляются из раскисляемого металла.
Для более полного удаления из стали неметаллических включений желательно и необходимо применять такие раскислители, которые образуют продукты взаимодействия с кислородом с температурой плавления ниже температуры жидкой стали. Этому условию не удовлетворяют чистые оксиды (MnO, SiО2, Al2O3 и др.), но удовлетворяют их легкоплавкие растворы и некоторые химические соединения, например, силикаты железа, марганца и др., получающиеся при применении комплексных раскислителей.
Таким образом, выбор раскислителей определяется не только сродством их к кислороду, но и необходимостью эффективного осуществления реакции раскисления и удаления неметаллических включений из металла.
Пример. Рассчитать равновесную концентрацию кислорода в расплавленном железе [%О], раскисленном Si и Mn, остаточные концентрации которых равны 0,2 и 1,0 %(мас) при Т = 1873К. Считать, что продукты раскисления образуют совершенный раствор.
Полученный результат сравнить с данными расчетов по раскислению железа только кремнием с образованием SiO2(ТВ) и только марганцем с образованием MnO(ТВ).
Решение. Реакции раскисления железа кремнием и марганцем:
 (1)
(1)
 (2)
(2)
Константы равновесия реакций  (3)
(3)
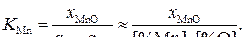 (4)
(4)
Здесь в I приближении считаем металлический раствор идеальным.
 и
и  – молярные доли компонентов в совершенном оксидном растворе, причем
– молярные доли компонентов в совершенном оксидном растворе, причем
 (5)
(5)
Подставляем в выражение (5)  и
и  из (3) и (4).
из (3) и (4).


 (6)
(6)
Из табличных данных для реакций
 (7)
(7)
 (8)
(8)
 и
и 
вычисляем для Т = 1873К  и
и 
Из выражения (6) определяем 

При раскислении железа только кремнием с образованием SiO2(ТВ) по реакции
 , (9)
, (9)
для которой  и
и 

При раскислении железа только марганцем с образованием MnO(ТВ) по реакции
 (10)
(10)
для которой  и
и 

Совместное раскисление кремнием и марганцем приводит к меньшим концентрациям кислорода в расплавленном железе
Количественно проявилась эффективность использования комплексного раскислителя, такого как силикомарганец.
При наличии двух элементов-раскислителей в сплаве продукты раскисления оказываются в растворе с пониженными активностями, что обусловливает снижение [O] по сравнению с применением каждого элемента-раскислителя в отдельности.
 2020-01-14
2020-01-14 608
608







