КУРСОВАЯ РАБОТА
СИНТЕЗ И СВОЙСТВА КОМПЛЕКСОВ ЖЕЛЕЗА (II) И ЖЕЛЕЗА (III)
Оглавление
Оглавление. 2
Введение. 3
1. Литературный обзор. 4
1.1 Теория кристаллического поля. 4
1.2 Мессбауэровская спектроскопия. 9
1.3 Комплексные соединения железа в растворе. 13
1.3.1 Гексацианоферраты(II, III). 14
1.3.2 Дитиосульфатоферрат (III). 18
1.3.3 Дифосфатоферрат. 18
1.3.4 Катион гексаамминжелеза (II). 18
1.3.5 Комплексы с другими лигандами. 19
1.3.6 Триоксалатоферраты (III, II) калия. 19
1.3.7 Хелаты. 20
1.3.7 Нитропруссид натрия. 22
2. Практическая часть. 25
2.1 Синтезы комплексов. 25
2.1.1 Синтез триоксалатоферрата (III) калия. 25
2.1.2 Синтез хелатного комплекса. 25
2.1.3 Выращивание кристалла берлинской лазури. 25
2.1.4 Выращивание кристалла турнбулевой сини. 26
Идентификация: 26
Выводы: 28
Список литературы. 29
Приложение. 31
Введение
Цель данной работы состоит в изучении строения и свойств комплексных соединений железа (II) и железа (III).
В ходе выполнения работы были поставлены следующие задачи:
1) изучение литературных данных о физических свойствах элементов VIIIB группы и их соединений, в частности, соединений железа;
2) анализ комплексных соединений железа (II) и железа (III) с различными лигандами с точки зрения теории кристаллического поля;
3) изучение литературных данных о строении цианидных комплексов железа (спектры Мессбауэра).
В ходе литературного поиска рассматриваются:
1) теория кристаллического поля;
2) эффект Мессбауэра;
3) комплексообразование в растворах.
В экспериментальной части предпринята попытка получения кристалла «берлинской лазури» - «турнбулевой сини», получены комплексы триоксалатоферрата(III) и хелатный комплекс.
Литературный обзор
Теория кристаллического поля
железо соединение лиганда кристаллическое поле
Для теоретического изучения комплексных соединений (КС) широко используется теория кристаллического поля (ТКП). Она была предложена Бетэ в 1929 г для кристаллов, а с 50-хх годов прошлого века стала широко использоваться в химии комплексных соединений [1].
Теория кристаллического поля исходит из того, что природа лигандов и их расположение вокруг центрального иона (симметрия комплекса) уменьшают вырождение d -орбиталей и изменяют их энергию. Рассмотрим это на примере комплексного иона октаэдрической симметрии [ML6]n+, в котором центральный атом имеет электронную конфигурацию d1. Ион M+ расположен в центре октаэдра, совпадающем с началом прямоугольной системы координат, а лиганды – в вершинах октаэдра.
Орбитали dx²–y² и dz² совпадают с координатными осями, а остальные три (dxy, dxz, dyz) проходят вдоль биссектрис соответствующих координатных углов. B отсутствие лигандов все пять орбиталей были энергетически равноценны. Но с появлением лигандов в вершинах октаэдра электроны, находящиеся на орбиталях dx²–y² и dz², испытывают сильное отталкивание от отрицательно заряженных лигандов или от отрицательного конца полярной молекулы. Другие три орбитали попадают в области с минимальными значениями отрицательного потенциала, поэтому вероятность нахождения электрона на орбиталях dxy, dxz, dyz будет больше. Это соответствует тому, что под действием лигандов прежде энергетически равноценные d -орбитали разделились на две группы: орбитали dx²–y² и dz²(dγ), энергетически невыгодные для электрона, и орбитали dxy, dxz, dyz(dε) с меньшей энергией. Схема расщепления d -орбиталей октаэдрическим (тетраэдрическим) окружением показана на рис. 1. Разность между dε и dγ -уровнями обозначается через Δокт (Δтетр) и называется параметром расщепления. В научной литературе орбитали обычно dγ и dε обозначают deg и dt2g, а параметр расщепления 10Dq [1].

рис 1. Диаграмма расщепления d-орбиталей в поле лигандов.
Из рис. 1 следует, что заселение любой dε -орбитали одним электроном приводит к уменьшению на 0,4Δокт энергии октаэдрического комплекса, т. е. стабилизирует его по сравнению со сферически симметричным ионом, а заселение электроном любой из dγ -орбиталей этот комплекс дестабилизирует на 0,6Δокт. В тетраэдрическом поле порядок расщепления d -орбиталей будет обратным, а потому энергия стабилизации на один электрон будет 0,6Δтетр, а дестабилизации - 0,4 Δтетр. Величина понижения энергии координационного соединения в результате перераспределения d -электронов по dε - и dγ -орбиталям называется энергией стабилизации кристаллическим полем (ЭСКП). Эта энергия зависит от числа электронов на dε- и dγ -орбиталях и вычисляется по формулам [1]:
ЭСКП(окт) = (0,4n – 0,6m) Δокт
ЭСКП(тетр) = (0,6n – 0,4m) Δтетр
где n – число электронов на нижнем подуровне, m – число электронов на верхнем подуровне. Параметр расщепления в октаэдрическом поле больше, чем в тетраэдрическом, содержащем те же лиганды, и равен Δокт = 9/4 Δтетр
Параметр расщепления Δ зависит от размеров центрального иона, его заряда, электронной конфигурации и от природы лиганда. Экспериментально его определяют по спектрам поглощения комплексных соединений. Возбуждение электрона с нижнего уровня на верхний сопровождается поглощением энергии и появлением в спектре полосы, максимум которой соответствует энергии расщепления Δ. Значение Δ обычно выражают в волновых числах ν = 1/λ см–1. Большинство значений Δ лежит в пределах о 10000 до 30000 см–1. (1 см–1 соответствует энергии E = hνc = 6,26∙10–34∙3∙1010∙1 = 2,0∙10–23 Дж = 11,96 Дж∙моль–1 = 1,25∙10–4 эВ) В ряду 3d-, 4d-, 5d- элементов при прочих равных условиях Δ увеличивается от периода к периоду на 30–35 %. Например, для [Co(NH3)6]3+ Δ = 23000 см–1, для [Rh(NH3)6]3+ Δ = 34000 см–1, для [Ir(NH3)6]3+ Δ = 41000 см–1. Величина Δ возрастает при переходе от комплексов двухрядных ионов 3d -элементов к трехрядным. Так для [Fe(H2O)6]2+ и [Fe(H2O)6]3+ значения Δ равны соответственно 10400 см–1 и 13700 см–1. Из спектроскопических измерений была найдена последовательность расположения лигандов по возрастанию их влияния на величину расщепления Δ, называемая спектрохимическим рядом лигандов [2]:
I- < Br- < SCN- «Cl- < F- < OH- «ONO- < C2O42- < OH2 < NCS- < ЭДТА4- < Py «NH3 < En < NO2- < ДМГ < CN- < CO.
Некоторые лиганды (роданид, нитрит) имеют два варианта присоединения и потому два места в ряду.
В октаэдрических комплексах, образуемых ионами с электронными конфигурациями d4, d5, d6, d7, возможно различное размещение электронов – либо высоко-, либо низкоспиновое в зависимости от параметра расщепления Δ и энергии спаривания P. Последняя определяется как разность энергий межэлектронного взаимодействия низкоспиновой (НС) и высокоспиновой (ВС) конфигураций, деленная на число спаривающихся электронов, и приводится в справочниках. Очевидно, что низкоспиновое состояние реализуется тогда, когда P < Δ, а высокоспиновое – когда P > Δ. Сведения о некоторых свойствах комплексов d-элементов представлены в таблице 1[1].
Таблица 1.
| Электронная конфигурация координ. иона | Ион-комплексообразователь | P, см–1 | Лиганды | Δ, см–1 | Электр. конфигурация октаэдр. иона | Спиновое состояние |
| d4 | Cr2+ | 23500 | H2O | 13900 |  | BC |
| Mn3+ | 28000 | H2O | 21000 |  | BC | |
| d5 | Mn2+ | 25200 | H2O | 7800 |  | BC |
| Fe3+ | 30000 | H2O | 13700 |  | BC | |
| d6 | Fe2+ | 17700 | H2O | 10400 |  | BC |
| 17700 | CN– | 33000 |  | HC | ||
| Co3+ | 21000 | F– | 1300 |  | BC | |
| 21000 | NH3 | 23000 |  | HC | ||
| d7 | Co2+ | 22500 | H2O | 10100 |  | BC |
В рамках ТКП высокоспиновый комплекс [Fe(H2O)6]2+ с электронной конфигурацией  будет менее устойчив (ЭСКП = 0,4Δокт), чем низкоспиновый [Fe(H2O)6]3+ (электронная конфигурация
будет менее устойчив (ЭСКП = 0,4Δокт), чем низкоспиновый [Fe(H2O)6]3+ (электронная конфигурация  ЭСКП = 2,4 Δокт).
ЭСКП = 2,4 Δокт).
Распределение электронов между нижним (dγ) и верхним (dε) уровнями в тетраэдрических комплексах также зависит от соотношения Δ и P, но поскольку Δтетр < Δокт, тетраэдрические комплексы обычно остаются высокоспиновыми.
В отличие от метода валентных связей, ТКП, основываясь на электронной конфигурации центрального атома, положении лигандов в спектрохимическом ряду и симметрии комплекса, позволяет не только объяснять, но и предсказывать магнитные и спектроскопические свойства комплексов.
С физической точки зрения ТКП является весьма приближенной, поскольку учитывает только электростатическое взаимодействие между комплексообразователем и лигандами. ТКП не дает объяснения устойчивости комплексов с электронными конфигурациями центрального атома d0 и d10, однако существование подобных комплексов легко объяснимо с позиций метода молекулярных орбиталей.
Таблица 2. Физические свойства элементов триады железа [2].
| Свойства | 26Fe | 27Co | 28Ni |
| Атомная масса | 55,85 | 58,93 | 58,70 |
| Электронная конфигурация | [Ar]3d64s2  | [Ar]3d74s2  | [Ar]3d84s2  |
 , нм , нм | 0,126 | 0,130 | 0,124 |
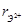 , нм , нм | 0,08 | 0,08 | 0,079 |
| Энергия ионизации Э0 → Э+, эВ | 0,58 | 0,94 | 1,28 |
| Возможные степени окисления | +2, +3, +6 | +2, +3 | +2, +3, +4 |
| кларк, ат.% (распространенность в природе) | 1,5 | 1∙10-3 | 3∙10-3 |
| Агрегатное состояние (н. у.) | Т В Е Р Д Ы Е В Е Щ Е С Т В А | ||
| Цвет | серебристо-серый | серо-стальной | серебристо-белый |
| tпл, 0С | 1539 | 1493 | 1455 |
| Tкип, 0С | 3070 | 2880 | 2800 |
| Плотность d, г/см3 | 7,87 | 8,9 | 8,91 |
Стандартный электродный потенциал  | -0,440 | -0,277 | -0,250 |
| Фото |  |  |  |
 2020-01-14
2020-01-14 747
747







