Это комплексное соединения образуется при взаимодействии железа 3+ с тиосульфатом натрия. Комплексное соединение окрашено в интенсивный фиолетовый цвет [8].
FeCl3+ 2 Na2S2O3 → 3 NaCl + Na[Fe(S2O3)2]
Далее окраска исчезает вследствие восстановления данной соли до бесцветной соли железа (II) тиосульфата и тетратионата [9].
2Na[Fe(S2O3)2] →FeS2O3+ FeS4O6+Na2S2O3
Дифосфатоферрат
В кислой среде фосфаты и фосфорная кислота с ионами железа образуют бесцветные комплексы [Fe(PO4)2] 3-[12]:
FeCl3 + H3PO4 + K3PO4 → K3[Fe(PO4)2] + 3HCl
Катион гексаамминжелеза (II)
Катион [Fe(NH3)6]2+ малоустойчив и водой мгновенно разлагается [14]:
[Fe(NH3)6]2+ + 6H2O = Fe(OH)2↓ + 4NH3∙H2O + 2NH4+
Комплексы с другими лигандами
К числу высокоспиновых комплексов Fe2+, образованных монодентантными лигандами, относятся акваионы [Fe(H2O)6]2+, КС с галогенид-ионами, например, K2[FeF4], в структуре которого зафиксированы конденсированные октаэдры [FeF6] [12].
Железо (II) в КС с полидентантными лигандами неустойчиво, так как быстро окисляется кислородом воздуха и водой, переходя в более термодинамически стабильные КС железа (III) [10].
Триоксалатоферраты (III, II) калия
Триоксалатоферрат (III) калия получают при взаимодействии сульфата железа (III), оксалата бария, и оксалата калия в водном растворе:
Fe2(SO4)3 + Ba2(C2O4)2 + 4K2C2O4 = 2K3[Fe(C2O4)3] + 2BaSO4 + K2SO4
Под действием света с длиной волны меньше 490 нм Fe(III) количественно восстанавливается до Fe(II) за счет окисления части ионов C2O42- до CO2 [14]:
2K3[Fe(C2O4)3] = 2K2[Fe(C2O4)2] + K2C2O4 + 2CO2 ↑
Образующийся при этом оксалатный комплекс железа (II) хорошо растворим в воде, и выделяется из раствора в виде кристаллогидрата K2[Fe(C2O4)2] ∙6H2O золотисто-желтого цвета.

Фото. 3. Триоксалатоферрат (II) калия
Хелаты
Термин хелат (англ. chelate от греческого «клешня») принят для обозначения циклических структур, которые образуются в результате присоединения катиона к двум или более донорным атомам, принадлежащим одной молекуле комплексона. В соответствии с термином хелат эти соединения следует представлять в виде какого-то краба, который своими полидентатными клешнями прочно захватывает ион металла, и чем больше клешней, тем прочнее захват. Как буквальный перевод слова chelate в литературе до сравнительно недавнего времени для обозначения комплексных соединений с циклическими структурами использовался термин "клешневидные соединения" [16].
Замыкание циклов при образовании хелатных соединений является важным фактором, обусловливающим высокую устойчивость комплексонатов. Комплексные соединения, содержащие циклические группировки, отличаются более высокой прочностью, чем соединения, не содержащие циклов, а наибольшей устойчивостью обладают комплексы с пяти- и шестичленными циклами.
Хелатные комплексы наиболее характерны для комплексонов. Термин «комплексоны» предложен в 1945 году профессором Цюрихского университета Г. Шварценбахом (1904 — 1978) для органических лигандов группы полиаминополикарбоновых кислот [16].
Наиболее часто используемым комплексоном является этилендиаминтетраацетат (ЭДТА, трилон-Б).
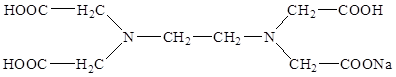
Комплекс железа с ЭДТА ([Fe(ЭДТА)(H2O)]-) относится к числу низкоспиновых[14]. В нем лиганд ЭДТА4-, как обычно, гексадентантен. Однако, КЧ иона Fe3+ равно 7, поскольку, кроме четырех атомов кислорода и двух атомов азота, ЭДТА4- во внутреннюю сферу КС входит атом кислорода внутрисферной гидратной воды:
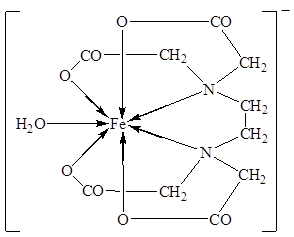
Образование хелатных структур характерно не только для комплексонов, но для других органических соединений. Например, очень устойчивы КС железа с бета-дикетонами. Простейший из бета-дикетонов железа – трисацетилацетонат Fe(AcAc)3 [14].
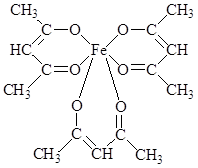
При нагревании сублимируется без разложения. В его молекуле имеются 3 шестичленных хелатных цикла. Несмотря на принадлежность к высокоспиновым соединениям, трисацетилацетонат железа (III) ведет себя как соединение с молекулярной структурой: ионная составляющая связи FeIII – лиганд экранируется углеводородными радикалами лиганда, в результате чего для соединения характерно слабое «органоподобное» межмолекулярное взаимодействие. Это объясняет его способность растворяться в малополярных растворителях и легко сублимироваться (150 0С).
В качестве неофициальных реакций наиболее чувствительным реактивом на железо (II) является спиртовой раствор диметилглиоксима, который образует с железа (II) ионом комплексное хелатное соединение красного цвета, нерастворимое в растворе аммиака [11]:
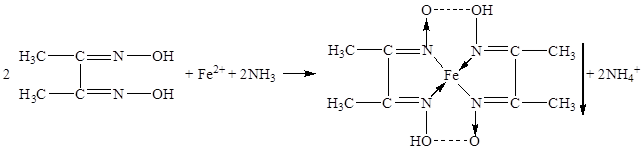
1.3.7. Нитропруссид натрия.
Производное гексацианоферрата (III) железа, называемое нитропруссидом натрия Na2[Fe(NO)+(CN)5]∙2H2O (кристаллы темно-красного цвета), можно получить, например, по реакции [14]:
Na3[Fe(CN)6] + NO = Na2[FeII(NO)+(CN)5] + NaCN
Таблица 3. Характеристика комплексных соединений железа.
| Название | Формула | Валентность железа | P | Δ | Спиновое состояние | Схема расщепления d-орбиталей |
| Тетрафтороферрат (II) | [FeF4]2- | 2 | 209,9 | 106,2 | ВС | 
|
| Нитропруссид | [Fe(NO)(CN)5]2- | 2 | 209,9 | НС | 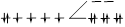
| |
| Гексаакважелезо (II) | [Fe(H2O)6] 2+ | 2 | 209,9 | 124,1 | ВС | 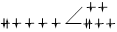
|
| Комплекс с диметилглиоксимом (ДМГ) | [Fe(C2(CH3)2N2OH(OH))2] | 2 | 209,9 | НС | 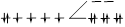
| |
| Гексаамминжелезо (II) | [Fe(NH3)6]2+ | 2 | 209,9 | 153,9 | ВС | 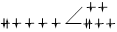
|
| гексацианоферрат(II) | [Fe(CN)6]4- | 2 | 209,9 | 403,2 | НС | 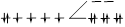
|
| гексацианоферрат(III) | [Fe(CN)6]3- | 3 | 357,9 | 417,6 | НС | 
|
| Дитиосульфатоферрат (III) | [Fe(S2O3)2]- | 3 | 357,9 | ВС | 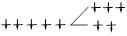
| |
| Дифосфатоферрат (III) | [Fe(PO4)2]3- | 3 | 357,9 | ВС | 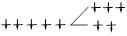
| |
| Триоксалатоферрат (III) | [Fe(C2O4)3]3- | 3 | 357,9 | ВС | 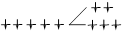
| |
| Комплекс с ЭДТА | [Fe(ЭДТА)H2O]- | 3 | 357,9 | НС | 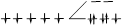
|
Практическая часть
Синтезы комплексов
 2020-01-14
2020-01-14 756
756








