Весьма интересны превращения карановых структур под действием суперкислот. В суперкислых средах увеличивается время жизни карбокатионов, что делает возможным их более глубокие вторичные превращения и вовлекает в перегруппировки все возможные реакционные центры: ЦПК. Двойные связи (если они есть), функциональные группы. Одна из таких возможностей — сигматропные сдвиги водорода или алкильных групп. При этом образуются новые катионы, каждый из которых имеет собственную судьбу. Естественно, что разнообразие интермедиатов, участвующих в этих перегруппировках, обеспечивает и разнообразие продуктов реакции.
При взаимодействии спирта 36 и его производных с суперкислотной системой HSO3F—SO2FCl была получена смесь продуктов, образование которых объясняется сигматропными сдвигами в первоначально возникающих ионах 124 и 125 (схема 2).36
Подобным образом протекает перегруппировка изомерного спирта 90. 36

Для осуществления циклизации такого типа требуется 1,2-водородный сдвиг в п -ментеновом ионе 126, так как атом кислорода гидроксиметильной группы удален от атома С(8), на котором возникает первоначальный заряд. В том случае, когда атом кислорода гидроксиметильной группы находится ближе к атому С(8), циклизация происходит через первоначально образующийся м -ментеновый ион 127. Конечно, 1,2-сдвиг происходит и в ионе 127, но атомы кислорода и углерода С(3) (на котором после сдвига сосредоточен положительный заряд) слишком сближены, поэтому циклизация не может осуществиться из-за стерического напряжения.
Циклизация диола 128 происходит без предварительного водородного сдвига через п -ментановый ион 129, в котором атом кислорода находится ближе к заряженному атому углерода, чем в ионе 126. При этом происходит селективное раскрытие циклопропанового кольца по связи С(1)—С(7); причина такой селективности пока не выяснена.36

Трициклический спирт 130 перегруппировывается в суперкислотной среде с раскрытием связи С(4)—С(5) с образованием соединения 131. Циклизация осуществляется за счет 1,2-сдвига водорода в катионе А.36

Перегруппировка спирта 130 примечательна тем, что его молекула имеет два трехчленных цикла, но под действием суперкислоты раскрывается только один из них. Это может быть связано с разницей энергий ВЗМО обоих циклопропановых фрагментов, имеющих различные заместители, хотя электростатическое влияние гидроксиметильиой группы на процесс, который контролируется зарядом, кажется неожиданно большим.
Перегруппировки, сопровождающиеся циклизацией, осуществляются в суперкислотных средах также для секокарановых структур.36 В этом случае положительный заряд должен быть сближен с кислородным атом, чтобы между ними образовалась связь.

При перегруппировках α- транс -3,4-эпоксикарана* (75) в суперкислотных средах в промежуточно образовавшихся ионах происходят не только водородные, но и алкильные сдвиги, и именно они ответственны за перестройку каранового скелета.117
В ионе 4-гидроксикарана 132 должен произойти 1,2-алкильный сдвиг, вызывающий сужение шестичленного цикла с образованием иона 133; выброс протона и ионизация ЦПК создают возможность циклизации (путь а).

Более интересен другой путь преобразования иона 132, формально происходящий как. 1,3-алкильный сдвиг и приводящий к иону 134 (путь b). Однако в заряженных системах не могут осуществляться 1,3-алкильные сдвиги: на атоме С(2) отсутствует подходящая p -орбиталь. Таким образом, в действительности происходит 1,2-алкильный сдвиг, но в образовании ПС участвуют атомы углерода, не являющиеся соседними (С(1) и С(3)). Перекрывание происходит не вдоль σ-связи, а через пространство; такой сдвиг можно назвать гомоенильным. В конечном итоге это приводит к замыканию трехчленного цикла и иону 134 (β-циклопропильная перегруппировка 118), в котором происходят последовательные водородный и алкильный сдвиги с образованием конечного кетона (+) -135. 117
Для объяснения перегруппировок β- цис -3,4-эпоксикарана (136) в суперкислотной среде предложен механизм с участием бициклического иона 137, изомерного иону 134. 118 В этом случае стереоспецифично образуется кетон (—) -135, который является не только стереоизомером, но и энантиомером кетона (+) -135, получающегося в процессе перегруппировок эпоксида 75.

Различную реакционную способность эпоксидов 75 и 136 авторы 118 объясняют термодинамическим и орбитальным факторами: ионы 132 и 138 имеют одинаково благоприятную для процесса сужения цикла ориентацию мигрирующей связи и вакантной орбитали. Для иона 132 энергетически более выгодным является процесс сужения цикла, а для иона 138 предпочтительна β-циклопронильная перегруппировка (через катионы 137 и 139), поскольку ориентация вакантной орбитали в этом катионе более благоприятна для перегруппировки, чем в ионе 132.
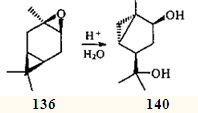
Приведенные выше схемы превращений эпоксидов 75 и 136 рассматривают лишь наиболее вероятные пути образования конечных продуктов. Соединения, имеющие углеродный скелет 1-метил-4-изопропилбицикло[3.1.0]гексана, которые могли бы получаться из ионов 134 и 137, среди продуктов превращения эпоксикаранов в суперкислотной среде не найдены. Однако в 1962 г, при кислотной гидратации цис -эпоксида 136 был получен диол 140 с таким же скелетом,119 и в 1972 г. была подтверждена его структура.120
В 1966 г. было показано, что одним из продуктов дегидратации моноацетата 3β, 4α-карандиола 141 является ацетат транс -1-метил-4-изопропенилбицикло[3.1.0]гексан-2-ола (142).121

Кропп, исследовавший эту реакцию,121 считая ее первым документально подтвержденным примером перегруппировки с трансаннулярным циклопропильным участием.10 Он полагал, что в реакциях нуклеофильного замещения ЦПК выступает в роли внутреннего нуклеофила и в подобных реакциях чрезвычайно велика роль стереохимического фактора: диметилциклопропановое кольцо должно иметь пространственную возможность атаковать атом С(3), несущий β-заместитель. Важно также наличие α-заместителя у атома С(4) для того, чтобы фиксировать шестичленный цикл в конформации " син -ванны" А. 121

Относительно высказанных Кроппом стереохимических условий "циклопропильного участия" существовали разные мнения. Предложенная им интерпретация пространственных особенностей протекания подобных реакций какое-то время считалась общепринятой и цитировалась в специальной литературе.12 Однако последующие исследования 10, 122-128 позволили выдвинуть и экспериментально обосновать предположение, что в переходном состоянии молекулы реагирующих карановых соединений имеют конформацию " анти -ванны" (B-D); ориентация заместителя при С(4) значения не имеет.122, 123, 129
Фактически "трансаннулярное участие ЦПК" сводится к 1,2-гомоенильному сдвигу, который может произойти (и происходит) в заряженных системах. Отсутствие продуктов "трансаннулярного циклопропильного участия" при перегруппировках в суперкислотах обусловлено тем, что вследствие чрезвычайно малой нуклеофильности среды и низких температур ионные процессы идут глубже и отличаются высокой селективностью. Поэтому в суперкислотах превращения не останавливаются на ионе 137, а идут дальше с образованием иона 139. который и приводит к конечному продукту реакции.

Такой подход объясняет общность превращений эпоксида 136 в условиях обычного кислотного катализа и в суперкислотах, но при этом возникают новые вопросы. Превращение зпоксида 75 в суперкислотах приводит к продуктам, предполагающим промежуточное образование иона 134, а сольволиз соединения 75 протекает без образования 1-метил-4-изопропилбицикло[3.1.0]гептановых структур. В качестве побочного продукта процесса происходит сужение цикла в результате алкильного сдвига в ионе 132, что приводит к иону 133, который стабилизируется путем выброса протона; в суперкислоте ион 133 подвергается перегруппировке.125, 130

Несомненно, эпоксиды 75 и 136 реагируют в обычных условиях по-разному вследствие различий в их пространственном строении. Однако в суперкислотах эти различия по отношению к "трансаннулярному циклопропильному участию" не проявляются или, по крайней мере, не играют существенной роли. Можно предположить, что в суперкислотах происходит более глубокое разделение зарядов, что меняет геометрию каранового скелета и создает возможность 1,2-сдвига. В обычных кислотах на участвующих атомах сконцентрирован лишь частичный заряд,121 поэтому геометрия каранового скелета изменяется незначительно. Следует, однако, отметить, что ион 133 образуется в условиях обычного кислотного катализа, что пока необъяснимо с точки зрения приведенной выше аргументации.
При взаимодействии α-эпоксикарана с альдегидами на глине асканит-бентонит (алюмосиликатный катализатор) не образуется продуктов, которые указывали бы на участие в реакции иона 134. 131

В этом случае глубокие превращения ионов не происходят, так как альдегид перехватывает ион 132 и реакция идет по другому пути. В то же время эпоксид 136 в аналогичных условиях дает продукты, которые свидетельствуют о том, что ион 138 претерпевает не только 1,2-гомоенильный, но и 1,2-алкильный сдвиг с образованием иона 133 (что не наблюдалось в суперкислотах 118), который затем перегруппировывается.

Специфика каталитических превращений на твердой поверхности приводит к тому, что из эпоксида 136 не образуется ацеталь с карановым скелетом, но получается кетон 44, который отсутствует в реакции эпоксида 75.
На глине асканит-бентонит 3-карен в реакции с альдегидами не вступает,131 но спирт 36 в этих условиях дает целый ряд перегруппированных продуктов, строение которых зависит от использованного альдегида.132


Предложенный авторами132 механизм реакции включает атаку молекулы протонированного масляного альдегида по более замещенному концу двойной связи и образование не третичного, а менее устойчивого вторичного катиона 143. Его перегруппировка с раскрытием ЦПК дает ионы 144, 145 и далее продукты реакции. В разделе II. 1 приводится другая точка зрения на образование продуктов с похожим скелетом.24, 25 В пользу механизма, предложенного в работе 132, свидетельствует получение трициклических продуктов в реакции спирта 36 с α-метилакролеином (схема 3).
Близость двойной связи и катионного центра в ионе 146 может привести к циклизации, которая, как полагают, обусловлена наличием метильной группы в α-положении к двойной связи.
Выше, на примерах эпоксикаранов, уже описывались перегруппировки каранового скелета в бицикло[3.1.0]гексановый. Похожая (с формальной точки зрения) перестройка каранового скелета наблюдается в процессе превращения оксима кар-2-ен-4-она (147) под действием азотистой кислоты.133 С учетом природы функционального заместителя наиболее вероятный путь превращения оксима 147 включает интермедиаты 148 - 152.

Очевидно, что за перестройку каранового скелета ответственен сдвиг алкильной группы в заряженной системе. Проведя квантово-химические расчеты, авторы 133 пришли к заключению, что 1,2-алкильный сдвиг в аллильном ионе 152 невозможен с точки зрения его пространственного строения и термодинамики. Что касается иона 151, то в нем предполагается согласованное элиминирование азота с одновременной атакой ацетатной группы и миграцией связи С(5)—С(6). Катион 153 стабилизируется захватом аниона NO2¯. Переходное состояние типа 151 постулировалось ранее130, 134 для объяснения пиролиза моноацетата карандиола 141.

Однако предложенный авторами циклический интермедиат 154 лишь формально - схематически описывает перестройку связей. Очевидно, что термический сдвиг связи С(2)—С(3) может произойти только в ионе. Возможно, уже отщепившаяся (но согласованному механизму) и присутствующая в реакции уксусная кислота способствует образованию промежуточных ионов.
Еще более удивительный пример скелетной перегруппировки, обусловленной участием оксииминной группы, описан в работе 135. Реакция оксимов 3α-гидроксиламинокаран-4-она (155а) и 3α-(O -ацетил)гидроксиламинокаран-4-она (155b) с боргидридом натрия в ацетонитриле приводит к продукту реакции 156 с семичленным конденсированным циклом.

В данном случае ацетонитрил, по-видимому, является не только растворителем, но и реагентом, так как и его отсутствие перегруппировка не происходит. АвторыI постулируют два возможных интермедиата реакции — А или В, — но отмечают, что механизм их образования пока неясен.
V.Выводы
Рассмотренный в курсовой работе обширный материал свидетельствует, что изучение химических превращений карановых производных выходит далеко за рамки того раздела органической химии, который принято называть химией терпеноидов. 3-Карен — поистине уникальное природное соединение, предоставляющее исследователям огромные возможности. Благодаря доступности 3-карена, из него сравнительно легко получают все новые производные, которые представляют интерес как сами по себе, так и служат прекрасными моделями для изучения механизмов реакций. По нашему мнению, среди природных соединений только бензол может сравниться с 3-кареном по вкладу в теоретическую и синтетическую органическую химию.
Хотя мы постарались рассмотреть механизмы известных перегруппировок, внимательный читатель, очевидно, отметил, что они часто носят гипотетический, а иногда и спорный характер. Нет сомнений, что исследования в этой области будут продолжены и не только дадут ответы на сегодняшние вопросы, но и поставят новые. Мы надеемся, что начатая нами аналитическая работа будет продолжена в рамках дипломного проекта.
Литература
1. S.Dev. Curr. Sci., 52, 1125 (1983)
2. B.V.Lawrence. Perfum.Flavor., 33 (3), 66 (2001)
3. Н.Ф.Салахутдинов, В.А.Бархаш. Успехи химии, 66, 376 (1997)
4. H.R.Sonawane, B.S.Nanjundiah, M.U.Kumar. Tetrahedron Lett., 25,2245(1984)
5. A.S.Khanra.K.K.Chakravarti, R.B.Mitra. Indian J. Cliem., 13,314 (1975)
6. А.Х.Хусид, О.М.Нефедов. Журн. Всесоюз. хим. о-ва им. Д.И.Менделеева, 33, 653 (1988)
7. С.А.Осадчий, Г.А.Толстиков. Химия в интересах устойчивого развития, 5,79 (1997)
8. H.Sadowska, J.Gora. Perfum. Flavor., 7 (1), 52 (1982)
9. J.Verghese. Perfum. Flavor., 4 (4), 23 (1979)
10. Б.А.Арбузов, З.Г.Исаева. Успехи химии, 45, 1339(1976)
11. C.P.Mathew, K.K.Sugathan, J.Verghese. J. Sci. Ind. Res., 22, 173 (1963)
12. W.F.Erman. In Studies in Organic Chemistry. Vol. 11. (Ed. P.Gassman). Marcel Dekker, New York, 1985. Pts A, B
13. D.H.Grayson. Nat. Prod. Rep., 15,439 (1998)
14. D.H.Grayson. Nat. Prod. Rep.. 17, 383 (2000)
15. Н.Ф.Салахутдинов. Химия в интересах устойчивого развития, 5,21(1997)
16. В.А.Бархаш, М.П.Половинка. Успехи химии, 68, 430 (1999)
17. В.А.Чуйко, Э.Н.Мануков, Ю.В.Чижов, М.М.Тимошенко. Химия природ. соединений, 639 (1985)
18. И.И.Бардышев, Э.Н.Мануков. Журн. орг. химии, 1, 1426 (1965)
19. A.D.Walsh. Trans. Faraday Soc., 45, 179 (1949)
20. A.de Meijere. Angew. Chem., Int. Ed. Engl., 18, 809 (1979)
21. W.Cocker, P.V.R.Shannon, P.A.Staniland. J. Chem. Soc. C, 915 (1967)
22. W.Cocker, D.P.Hanna, P.V.R.Shannon. J. Chem. Soc. C, 489 (1968)
23. W.Cocker, D.P.Hanna, P.V.R.Shannon. J. Chem. Soc. C, 1302 (1969)
24. J.Chlebicki, B.Burczuk. Tetrahedron Lett., 4775 (1970)
25. J.Chlebicki, B.Burczuk. Rocz. Chem., 45, 1225(1971)
26. K.Gollnick, G.Schade, S.Schroeter. Tetrahedron, 22, 139 (1966)
27. K.Gollnick, G.Schade. Tetrahedron Lett., 2335 (1966)
28. А.А.Фокин, Е.Д.Бутова, И.В.Коломицин, Е.А.Гагаева, И.В.Гогоман, А.М.Корнилов, А.Е.Сорочинский, А.Г.Юрченко, П.А.Красуцкий. Журн. орг. химии, 30, 669 (1994)
29. В.А.Чуйко.Э.Н.Мануков, Н.Г.Яремченко. Весцi АН Беларуci. Сер. хiм. нaвук, (3), 70 (1996)
30. A.R.Rossi. J. Phys. Chem., 83, 2554 (1979)
31. F.H.Allen. Acta Crystullogr., Sect. B, 36, 81 (1980)
32. О.Г.Выглазов, Э.Н.Мануков, В.А.Чуйко, Т.Р.Урбанович. Журн. орг. химии, 28, 968 (1992)
33. W.Cocker, H.St.J.Lauder, P.V.R.Shannon. J. Chem. Soc.. Perkin Trans. 1,332(1975)
34. Г.А.Толстиков, А.Ю.Спивак, Л.М.Халилов, Е.В.Васильева, С.И.Ломакина, И.А.Иванова. Изв. АН СССР. Сер. хим., 1814 (1985)
35. Э.Н.Мануков, О.Г.Выглазов, В.А.Чуйко, Е.С.Мардилович. Журн. орг. химии, 24, 1449 (1988)
36. М.П.Половинка, О.Г.Выглазов, Д.В.Корчагина, Э.Н.Мануков, В.А.Бархаш. Журн. орг. химии, 28, 2253 (1992)
37. В.А.Чуйко, О.Г.Выглазов, Л.Ю.Тычинская. Журн. орг. химии, 34,1357(1998)
38. T.Norin, S.Strombcrg, M.Weber. Chem. Scr., 20, 49 (1982)
39. H.R.Sonawane, B.S.Nanjundiah, P.C.Purohit. Tetrahedron Lett., 24,3917(1983)
40. W.J.Leigh, R.Srinivasan. J. Am. Chem. Soc., 105, 514 (1983)
41. H.Hart, T.Takino. J. Am. Chem. Soc., 93, 720 (1971)
42. P.J.Kropp. J. Am. Chem. Soc., 89, 1126 (1967)
43. H.R.Sonawane, V.G.Naik, B.S.Nanjundiah, P.C.Purohit. Tetrahedron Lett., 24, 3025 (1983)
44. D.C.Heckert, P.J.Kropp. J. Am. Chem. Soc., 90, 4911 (1968)
45. G.Buchi, E.M.Burgess. J. Am. Chem. Soc., 82, 4333 (1960)
46. R.K.Murray Jr.,, T.M.Ford. J. Am. Chem. Soc., 102, 3194 (1980)
47. J.A.Bcrson, M.R.Willcott III. J. Am. Chem. Soc., 88, 2494 (1966)
48. E.Ciganec. J. Am. Chem. Soc., 87, 652 (1965)
49. G.Maier. Angew. Chem., 79, 446 (1967)
50. F.-G. Klarner. Tetrahedron Lett., 19 (1974)
51. G.Maas, M. Regitz. Chem. Ber., 109, 2039 (1976)
52. R.Neidlcin, C.M.Radke. Helv. Chim. Acta, 66, 2626 (1983)
53. R.Hoffmann. Tetrahedron Lett., 2907 (1970)
54. M.Gorlitz, H.Gunther. Tetrahedron, 25, 4467 (1969)
55. E.Ciganec. J. Am. Chem. Soc., 93, 2207 (1971)
56. R.B.Woodward, R-HofTmann. Angew. Chem., 81, 797 (1969)
57. M.B.Rubin. J. Am. Chem. Soc., 103, 7791 (1981)
58. И.И.Бардышсв, Г.В.Дещиц, А.А.Вахрамеева. Весцi АН Беларуci. Сер. хiм. нaвук, (2), 69 (1980)
59. A.Baeyer. Berichfe, 27, 810 (1894)
60. T.Saecd, P.J.Sondra, M.J.E.Verzcle. Phytochemistry, 17, 1433 (1978)
61. E.J.Corey, H.J.Burke. J. Am. Chem. Soc., 78, 174 (1956)
62. E.J.Corey, H.J.Burke, W.A.Remers. J. Am. Chem. Soc., 78, 180 (1956)
63. W.D.P.Burns, M.S.Carson, W.Cocker, P.W.R.Shannon. J. Chem Soc.C, 3073 (1968)
64. О.Г.Выглазов, Э.Н.Мануков, Б.Г.Ударов, Г.Н.Бажина, Т.Р.Урбанович, Л.В.Изотова. Химия природ, соединений, 289 (1989)
65. О.Г.Выглазов, Э.Н.Мануков, М.Н.Федорищева, Н.Г.Арико, В.А.Чуйко, Г.Н.Бажина. Химия природ, соединений, 328 (1991)
66. L.Ruzicka. Pure Appl. Chem., 6, 493 (1963)
67. Г.А.Рудаков, Ю.А.Подтавченко, Л.С Иванова. В кн. Синтетические продукты из канифоли и скипидара. Волго-Вятское книжное изд-во, Горький, 1970. С. 156
68. Э.Н.Мануков, В.А.Чуйко, П.В.Кузьмичкин. Химия природ. соединений, 783(1979)
69. Э.Н.Мануков, В.А.Чуйко. Химия природ, соединений, 450 (1983)
70. W.Cocker, P.V.R.Shannon, P.A.Staniland. J. Chem. Soc. C, 41 (1966)
71. G.O.Schenck. Angew. Chem., 69, 579 (1957)
72. Э.Н.Мануков, В.А.Чуйко. Химия древесины, (4), 48 (1983)
73. S.M.Davis, G.A.Somorjai. J. Calal., 65, 78 (1980)
74. Э.Н.Мануков, В.А.Чуйко, О.Г.Выглазов. Химия природ. соединений, 259 (1982)
75. Э.Н.Мануков, В.А.Чуйко, О.Г.Выглазов. Журн. орг. химии, 20, 289(1984)
76. Э.Н.Мануков, В.А.Чуйко, Е.С.Мардилович, О.Г.Выглазов. Весцi АН Беларуci. Сер. хiм. нaвук, (3), 55 (1988)
77. Э.Н.Мануков, Г.Н.Бажина. Журн. орг. химии, 24, 121 (1988)
78. Э.Н.Мапуков, В.А.Чуйко, О.Г.Выглазов. Журн. орг. химии, 19, 662(1983)
79. Э.Н.Мапуков, О.Г.Выглазов, В.А.Чуйко, И.А.Шингсль. Журн. орг. химии, 21, 2089 (1985)
80. О.Г.Выглазов, В.А.Чуйко, Э.Н.Мапуков. Весцi АН Беларуci. Сер. хiм. нaвук, (6), 40 (1988)
81. Э.Н.Мануков, О.Г.Выглазов, И.А.Шингель. Весцi АН Беларуci. Сер. хiм. нaвук, (1), 67 (1986)
82. Э.Н.Мануков, О.Г.Выглазов. Химия природ., соединений, 534 (1983)
83. G.Ohloff, H.Farnow, W.Phillipp. Liehigs Ann. Chem., 613, 43 (1958)
84. О.Г.Выглазов, Э.Н.Мануков, В.А.Чуйко, Б.Г.Ударов. Весцi АН Беларуci. Сер. хiм. нaвук, (3), 42 (1991)
85. Т.Джилкрист, Р.Сторр. Органические реакции и орбитальная симметрия. Мир, Москва, 1976
86. Э.Н.Мапуков, Т.Р.Урбанович, О.Г.Выглазов, В.А.Чуйко, Е.Д.Скаковский. Химия природ. соединений, 193 (1989)
87. D.S.Glass, R.S.Boikcss, S.Winstcin. Tetrahedron Lett., 999 (1966)
88. C.A.Coulson,W.E.Moffitt. Phylos. Mag., 40, 1 (1949)
89. M.C.Flowers, H.M.Frcy. J. Chem. Soc., 3547 (1961)
90. G.Ohloff. Chem. Ber., 93, 2673 (1960)
91. G.Ohloff. Tetrahedron Left., 3795 (1965)
92. K.Gollnik. Tetrahedron Lett., 327 (1966)
93. R.J.Loncharich, K.N.Houk. J. Am. Chem. Soc., 110, 2089 (1988)
94. О.Г.Выглазов, С.Л.Быховсц, Э.Н.Мануков, Т.Р.Урбаиович. Весцi АН Беларуci. Сер. хiм. нaвук, (2), 65 (1991)
95. W.von Doering, E.K.G.Schmidt. Tetrahedron, 27, 2005 (1971)
96. L.L.Frolova, A.V.Kutchin. In International Conference on Natural Products and Physiologically Active Substances. (Abstracts of Reports). Novosibirsk, 1988. P. 109
97. В.А.Чуйко, Э.Н.Мануков, О.Г.Выглазов. Докл. АН БССР. 30, 158(1986)
98. В.А.Миронов, А.Д.Фeдорович, А.А.Ахрем. Успехи химии, 50, 1272(1981)
99. W.J.Bouma, M.A.Winecnt, L.Radom. Int. J. Quantum Chem., 14, 767(1978)
100. J.A.Berson, L.Salem. J. Am. Chem. Soc., 94. 8917 (1972)
101. A.P.ter Borg, H.Kloosterziel, N.van Meurs. Proc. Chem. Soc., London, 359 (1962)
102. F.-G.Klarner. Angew. Chem.. Int. Ed. Engl., 13, 268 (1974)
103. F.-G.Klarner, S.Yaslak, M.Wcttc. Chem. Ber., 112, 1168 (1979)
104. F.-G.Klarner, B.Brassel. J. Am. Chem. Soc., 102, 2469 (1980)
105. A.Jarzecki, J.Gajewski, E.R.Davidson. J. Am. Chem. Soc., 121, 6928(1999)
106. A.Kless, M.Nendel, S.Wilsey, K.N.Houk. J. Am. Chem. Soc., 121, 4524(1999)
107. Э.Н.Мануков, О.Г.Выглазов, В.А.Чуйко, Е.Д.Скаковский. Журн. орг. химии, 22, 1105 (1986)
108. Э.Н.Мануков, О.Г.Выглазов, В.А.Чуйко. Весцi АН Беларуci. Сер. хiм. нaвук, (5), 58 (1989)
109. Э.Н.Мануков, О.Г.Выглазов, Б.Г.Ударов. Весцi АН Беларуci. Сер. хiм. нaвук, (4), 51(1990)
110. M.Nendel, B.Goldfuss, B.Beno, K.N.Houk, K.Hafner, H.-Y.Lindner. Pure Appl. Chein., 71, 221 (1999)
111. D.A.Modarelli. J. Org. Chem., 65, 7277 (2000)
112. О.Г.Выглазов, Э.Н.Мануков. Весцi АН Беларуci. Сер. хiм. нaвук,(5), 111(1988)
113. Г.Н.Бажипа, В.А.Чуйко, Э.Н.Мануков. Весцi АН Беларуci. Сер. хiм. нaвук, (4), 47 (1993)
114. О.Г.Выглазов, Э.Н.Мануков, В.А.Чуйко. Журн. орг. химии, 25, 1571 (1989)
115. В.А.Чуйко, О.Г.Выглазов, Э.Н.Мануков, Л.Ю.Тычинская. Весцi АН Беларуci. Сер. хiм. нaвук, (2), 54 (1998)
116. W.von Docring, W.R.Roth. Tetrahedron. 19, 715 (1963)
117. М.П.Половинка, О.Г.Выглазов, Д.В.Корчагина, В.А.Бархат. Журн. орг. химии, 27, 2623 (1991)
118. М.П.Половинка, Д.В.Корчагина, Ю.В.Гатилов, О.Г.Выглазов, Г.А.Зенковец, В.А.Бархаш. Журн. орг. химии, 34, 1342 (1998)
119. Z.Chabudzinski, H.Kuczynski. Roc:. Chem., 36, 1173 (1962)
120. Б.А.Арбузов, В.А.Шайхутдннов, З.Г.Исаева. Изв. АН СССР. Сер. хим., 2124(1972)
121. P.J.Kropp.. J. Am. Chem. Soc., 88, 4926 (1966)
122. Б.А.Арбузов, З.Г.Исаева, Р.Р.Дьяконова. Изв. АН СССР. Сер. хим., 2778 (1980)
123. Б.А.Арбузов, З.Г.Исаева, Р.Р.Дьяконова. Изв. АН СССР. Сер.хим., 2141 (1980)
124. Б.А.Арбузов, З.Г.Исаева, Р.Р.Дьяконова. Изв. АН СССР. Сер. хим., 972 (1975)
125. Б.А.Арбузов, З.Г.Исаева, Э.Х.Казакова. Докл. АН СССР, 215, 113(1974)
126. H.Kuczynski, M.Walkowicz, C.Walkowicz, K.Nowak, I.Sicmion. Rocz. Chem., 38, 1625 (1964)
127. M.Walkowicz, H.Kuczynski. Rocz. Chem., 40, 1231 (1966)
128. E.Maslinski, E.Michalek. Rocz. Chem., 47, 285 (1973)
129. Р.Р.Дьяконова, А.А.Мусина, Р.Г.Гайнуллина, П.П.Чернов. Изв. АН СССР. Сер. хим., 1327 (1982)
130. J.C.Leningwell, R.E.Shackelford, H.J.Young. Synth. Comimm., 105(1972)
131. К.П.Волчо, Л.Е.Татарова, Д.В.Корчагина, Н.Ф.Салахутдинов, В.А.Бархаш. Журн. орг. химии, 36, 41 (2000)
132. И.В.Ильина, К.П.Волчо, Д.В.Корчагина, Н.Ф.Салахутдинов, В.А.Бархаш. Журн. орг. химии, 35, 699 (1999)
133. A.V.Tkachev, A.M.Chibiryaev, A.Yu.Denisov, Yu.V.Gatilov. Tetrahedron. 51, 1789(1995)
134. J.C.Lemngwell, R.E.Shackelford. Tetrahedron Lett., 2003 (1970)
135. P.A.Petukhov, A.Yu.Denisov, A.V.Tkachev. Tetrahedron, 53, 2527 (1997)
* Символами α и β в химии терпеноидов традиционно указывают пространственное расположение функциональных групп производных карана: α -заместители и трехчленный цикл расположены по разные стороны циклогексанового кольца (транс). β-заместители и ЦПК — по одну сторону (цис).
 2020-01-14
2020-01-14 179
179







