СПЕКТРОФОТОМЕТРИЯ
План лекции
1. Классификация методов спектрального анализа
2. Теоретические основы спектрофотометрических методов
3. Спектрофотометрические законы
4. Ограничения и условия применимости закона Бугера – Ламберта – Бера
5. Аппаратура для спектрофотометрического метода
6. Погрешности измерения светопоглощения
7. Способы определения концентраций
Литература
1. Лекции по аналитической химии. Учебное пособие / Сост.: А.С. Алемасова, Л.Я. Еналь-ева. – Донецк: ДонНУ, 2007. – С.230-239.
2. Пилипенко А.Т., Пятницкий И.В. Анали-тическая химия. В 2-х книгах. – М.: Химия, 1990. – Кн.1.– С. 292-368; Кн.2. – С. 756-769, 778-785.
3. Пономарев В.Д. Аналитическая химия. В 2-х частях. – М.: Высшая школа, 1982. – Ч.2. – С. 151-153, 172-183, 211-217.
4. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая шко-ла, 2001. – Кн.2. – С. 303-370.
5. Основы аналитической химии. В 2-х кни-гах/ Под ред. Ю.А.Золотова. – М.: Высш.шк., 2004. – Кн.2. – С. 273-328, 360-372.
6. Васильев В.П. Аналитическая химия. В 2-х книгах. – М.: Дрофа, 2002. – Кн.2. – С. 50-92, 98-127.
Классификация методов спектрального анализа
Все спектральные методы анализа основаны на использовании различных явлений, возникающих при взаимодействии вещества и электромагнитного излучения.
Классификация методов спектрального анализа:
І. Анализ может быть атомным и молекулярным.
Атомный – устанавливает, какие элементы входят в состав анализируемой пробы и определяет концентрацию элементов в пробе.
Молекулярный спектральный анализ устанавливает природу индивидуального соединения, расшифровывает структуру молекулы, идентифицирует и определяет индивидуальные компоненты смеси.
ІІ. Методы анализа по спектрам поглощения называют абсорбционными. Методы анализа по спектрам испускания – эмиссионными или флуоресцентными.
• В эмиссионном анализе частицы вещества возбуждаются в источнике света (пламя, разряд), куда вводится анализируемая проба.
• В флуоресцентном анализе частицы вещества возбуждаются квантами электромагнитного излучения, которые направляются на анализируемую пробу от внешнего источника.
III. По способу регистрации спектра:
визуальные, фотографические и фотоэлектрические.
IV. Классификация методов спектрального анализа в зависимости от вида электромагнитного излучения, испускаемого или поглощаемого веществом
Таблица 1. Классификация методов спектрального анализа
| Длина волны | Вид электромагнитного излучения | Взаимодействие с веществом | Метод анализа |
| 10–4–10–2 нм | γ - излучение | возбуждение ядер | активационный анализ |
| 10–2-10 нм | рентгеновское (X-ray) | возбуждение внутренних электронов | рентгеновская спектроскопия, масс-спектральный анализ |
| 100-400 нм | ультрафиолет | возбуждение валентных электронов | атомно-эмиссион-ный, атомно-абсорбционный методы, спектрофотометрия |
| 400-760 нм | видимое | возбуждение валентных электронов | атомно-эмиссион-ный, атомно-абсорбционный методы, спектрофотометрия |
| 760 нм-1000 мкм | ИК-излучение | колебания молекул | ИК-спектроскопия |
| 0,1-100 см | микроволны | вращение молекул, магнитные диполь-ные переходы | ЭПР-спектроскопия |
| 1-1000 см | радиоволны | магнитные диполь-ные переходы | ЯМР-спектроскопия |
2. Теоретические основы спектрофотометрических методов
Спектрофотометрический метод относится к молекулярным абсорбционным методам. Молекулярная абсорбционная спектроскопия основана на поглощении электромагнитного излучения веществами. В зависимости от энергии поглощаемых фотонов различают абсорбционную спектроскопию в видимой, ультрафиолетовой, инфракрасной, микроволновой, рентгеновской областях. Спектроскопию в видимой и УФ-областях традиционно называют спектрофотометрией. Энергия фотонов в этих областях спектра достаточна для переходов электронов в молекуле с одного энергетического уровня на другой.
Молекулы состоят из двух и более атомов, соединенных между собой в определенном порядке химическими связями, образующимися при взаимодействии внешних электронов. При этом атомы сближаются, но так, что их завершенные оболочки не соприкасаются. Энергетическое строение молекулы сложнее, чем у атома. Наряду с движением электронов происходит колебательное движение самих атомов, вернее их ядер, и вращение молекулы как целого. Поэтому в любом стационарном состоянии энергия молекулы складывается из электронной, колебательной и вращательной энергий:
Е = Еэл + Екол + Евр.
Наибольший вклад в полную энергию вносит энергия электронов, наименьший – энергия вращения молекулы:
Еэл >> Екол >> Евр.
Вращение молекул проявляется у веществ лишь в газообразном состоянии, в конденсированных состояниях (жидком и твердом) вращение затруднено.
Так же как и атом, молекула может существовать только в определенных энергетических состояниях, называемых энергетические уровни. Каждому электронному состоянию отвечают колебательные уровни, а каждому колебательному уровню – вращательные (рис.1).
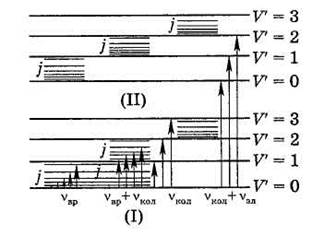
 Рис. 1. Схема энергетических уровней молекулы в основном (I) и первом возбужденном (II) электронных состояниях
Рис. 1. Схема энергетических уровней молекулы в основном (I) и первом возбужденном (II) электронных состояниях
Основному электронному состоянию (I) отвечает система колебательных уровней, характеризуемая колебательными квантовыми числами V = 0, 1, 2,…. Возбужденное электронное состояние (II) обладает системой колебательных уровней с квантовыми числами V´ = 0, 1, 2, …. У каждого колебательного состояния есть система вращательных уровней, энергия которых пропорциональна вращательному квантовому числу j.
При обычных условиях большинство молекул находится в основном электронном и основном колебательном состояниях. Переходы νвр в этих условиях (рис.1) характеризуют чисто вращательные спектры, линии которых появляются в самой далекой длинноволновой части ИК-спектра и в области микроволн.
Чисто колебательные переходы νкол (рис.1) происходят при неизменном электронном состоянии молекулы. В случае разреженных газов наблюдается колебательно-вращательные спектры молекул νкол + νвр, характеризующие переходы между вращательными уровнями различных колебательных состояний.
Электронные переходы являются наиболее сложными в связи с наложением колебательных, а при определенных условиях и вращательных переходов. Наложение большого числа колебательных переходов часто приводит к существенному уширению полос электронных спектров.
В соответствии с положениями метода молекулярных орбиталей электроны в молекуле могут находится на связывающих, несвязывающих и разрыхляющих орбиталях. Различные электронные переходы требуют неодинаковой энергии, поэтому полосы поглощения располагаются при разных длинах волн. Схема относительного расположения энергетических уровней, соответствующих разнвм молекулярным орбиталям, показана на рис.2.
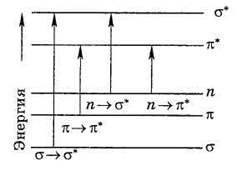
Рис. 2. Схема электронных уровней и энергия возможных электронных переходов
Наибольшей энергии требует σ →σ* – переход, связанный с возбуждением внутренних электронов. Он соответствует поглощению в далекой ультрафиолетовой области (λ ≤ 200 нм). Такие переходы характерны, например, для метана, этана и других насыщенных углеводородов. Переход n→σ* связан уже с меньшими затратами энергии. Полосы, вызванные этим переходом, расположены в обычном (невакуумном) ультрафиолете (λ = 200 – 300 нм). Еще меньшая энергия требуется для перехода на разрыхляющие π*-орбитали. Переходы n→π* и π→π* встречаются в молекулах соединений с сопряженными связями и молекулах ароматических соединений. Этими же переходами можно объяснить, например, интенсивную окраску ионов MnO4–, CrO42– (переход с несвязывающей орбитали кислорода).
Типы соединений, применяемых в спектрофотометрическом анализе:
1. Однороднолигандные комплексы с неорганическими лигандами:
– роданидные и галогенидные комплексы (определение Fe(III), Mo, W, Bi, Re, Co);
– аммиакаты (определение Cu2+);
– комплексы металлов с пероксидом водорода (определение Ti, V, Nb, Ta, Ce);
– гетерополикислоты (определение P, Si, As, Nb, V, Ge).
2. Однороднолигандные хелатные комплексы:
– соединения металлов с полифенолами и оксикислотами (Fe3+, Ti, Nb, Ta);
– соединения металлов с органическими красителями типа ализарин (Al, РЗЭ, Zr, Hf);
– соединения металлов с органическими реактивами, содержащими аминный азот (Hg, Al, Mg, Co);
– соединения металлов с органическими реагентами, содержащими нитро - и нитрозогруппы (Co, K, Fe3+);
– соединения металлов с органическими реагентами, содержащими тионную - и тиольную группы (определение Hg, Ag, Pb, Cd, Cu, Bi, Sn, Sb, Zn, As, Fe, Ni, Co).
3. Разнолигандные и разнометальные комплексы. К этой группе отнесены также ионные ассоциаты, которые близки к ней, но отличаются по природе химической связи.
4. Окрашенные соединения, получаемые при реакциях окисления – восстановления (определение Mn, Cr, Ni, As, Se, Te).
5. Малорастворимые соединения и соединения адсорбционного характера (определение NH4+, Mg2+, Na+, Sb3+).
6. Органические соединения, получаемые при реакциях синтеза с участием неорганических веществ (определение NH4+, NO2–, NO3–).
7. Аква-ионы и другие простые соединения, обладающие собственным поглощением (определение Fe3+, Ni, Co, Cu, Cr, оксидов азота и др. по собственному поглощению).
8. Кислотно-основные индикаторы (определение рН).
3. Спектрофотометрические законы
Количественно поглощение системой излучения описывается законами Бугера – Ламберта – Бера и аддитивности.
 2020-04-12
2020-04-12 5925
5925