Для решения этих задач нужно пользоваться
- соотношением: 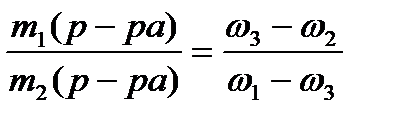
- или «правилом креста»:
Большая массовая доля ω1 ω3 – ω2
ω3
меньшая массовая доля ω2 ω1 – ω3
- или формулой: ω3 = 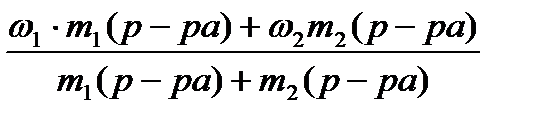
4.1. Какую массу соды (Na2CO3· 10H2O) надо растворить в 500 г воды, чтобы получить двухпроцентный раствор карбоната натрия?
Дано: ω(Na2CO3 ) = 2 % или 0,02 Найти: m (Na2CO3· 10H2O)
m(Н2О) =500 г
Решение:
1) вычислим массовую долю безводной соли в кристаллогидрате:
ω (б.с.) = М (б.с.) / М (кр-та)
ω (б.с.) = 106 г/моль / 286 г/моль = 0,37
2) Составим диагональную схему, приняв кристаллогидрат за «раствор», а воду - за «раствор с массовой долей 0%» и вычислим массовые части каждого «раствора»:
0,37 0,02
0,02
0 0,35
3) определим соотношение масс кристаллогидрата и воды:
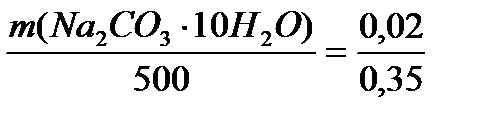 ,отсюда
,отсюда
масса кристаллогидрата: m (Na2CO3· 10H2O) ·0,35 = 500· 0,02 =28,57 (г)
Ответ: m (Na2CO3· 10H2O) = 28,57 (г)
4.2. Какова массовая доля раствора, полученного сливанием 10 мл 24%-го раствора гидроксида натрия (ρ = 1,22г/см3) и 10 мл 49%-ого (ρ=1,53г/см3) раствора гидроксида натрия
Дано: V1 (р-ра)=10 мл Найти: ω3(NaОН)
ρ1 = 1,22г/см3
V2(р-ра) = 10 мл
ρ2=1,53г/см3
ω1(NaОН) = 24 % или 0,24
ω2(NaОН) = 49 % или 0,49 Решение:
1) вычислим массы растворов: m = ρ · V
m1 (р-ра) = 1,22г/см3 · 10 мл = 12,2 г
m2 (р-ра) = 1,53г/см3 · 10 мл = 15,3 г
2) составим диагональную схему:
0,49 ω3 – 0,24 массовая часть первого раствора
ω3
0,24 0,49 - ω3 массовая часть второго раствора
3) получим соотношение:
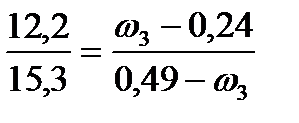 ,
,
откуда 15,3 (ω3 – 0,24) =12,2 (0,49 - ω3)
15,3 ω3 – 3,672 =5,978 – 12,2ω3
15,3 ω3 + 12,2ω3 =5,978 + 3,672
27,5 ω3 =9,65
ω3 = 37,9 %
Ответ: ω3 (NaОН) = 28,49 %
Задачи, связанные с выпариванием воды
5.1.Насыщенный при 200 раствор хлорида кобальта нагрели и выпарили 60 г воды. После охлаждения до исходной температуры выделилось 103,8 г кристаллогидрата CoCl2 · 6H2O. Определите массовую долю соли в исходном растворе.
Дано: m(Н2О) = 60 г Найти: ω1 (CoCl2)
m (CoCl2 · 6H2O) = 103,8 г
Решение
1) определим массу безводной соли в кристаллогидрате по формуле:
ω (б.с.) = М (б.с.) / М (кр-та)
ω (б.с.) = 130 г/моль / 238 г/моль = 0,546
2) составим диагональную схему:
Большая массовая доля ω1 ω3 – ω2
ω3
меньшая массовая доля ω2 ω1 – ω3
Примем воду за раствор с массовой долей 0 %, а кристаллогидрат за раствор с массовой долей равной массовой доли безводной соли:
0,546 ω1
ω1
0 0,546 – ω1
3) Найдем соотношение масс кристаллогидрата и воды и решим пропорцию:
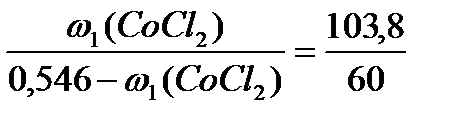 ;
;
Ответ: ω1 (CoCl2) = 0,346 (34,6 %)
 2020-04-12
2020-04-12 171
171








