Задачи данного типа также как и другие задачи с растворами можно решать тремя способами.
6.1. Из 500 г раствора с массовой долей 0,25,выделилось 40 г безводной соли при охлаждении. Определите массовую долю соли в оставшемся растворе.
Дано: m1(р-ра)=500 г Найти: ω2
ω1 = 0,25
m (б.с.)= 40 г Решение:
Способ
1) найдем массу соли в исходном растворе по формуле:
m(в-ва) = ω · m1(р-ра)
m1(в-ва) = 0,25 · 500 = 125 (г)
2) Найдем массу соли в растворе после образования осадка:
m2(в-ва) = m1(в-ва) – 40
m2(в-ва) = 125 - 40 = 85 (г)
3) вычислим массу раствора после охлаждения, т. е. после выпадения осадка:
m2(р-ра)=500 - 40 = 460 (г)
4) рассчитаем массовую долю соли в оставшемся растворе по формуле:
ω2 = 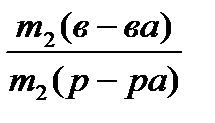 ; ω2 =
; ω2 = 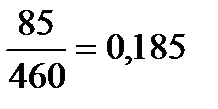
Ответ: ω2 = 0,185
2 способ: с помощью «правила креста»
1. Исходный раствор можно получить, растворив осадок вещества при нагревании. Примем массовую долю осадка за 1 и составим диагональную схему («крест»):
1 0,25 – ω2 массовая часть соли
0,25
ω2 0,75 массовая часть нового раствора
2.Вычислим массу раствора после охлаждения:
m2(р-ра)=500 - 40 = 460 (г)
3. Определим отношение масс выделившегося осадка и нового раствора
и из получившейся пропорции вычислим массовую долю соли
в полученном растворе:
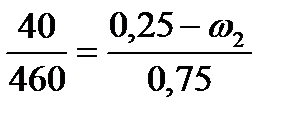 ; отсюда 40 · 0,75 = 460 · (0,25 - ω2 )
; отсюда 40 · 0,75 = 460 · (0,25 - ω2 )
ω2 = 0,185
Ответ: ω2 = 0,185
3 способ: по формулам.
1. Запишем расчетную формулу: ω2 = 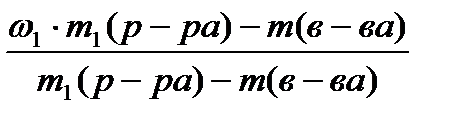
2. Вычислим массовую долю соли в растворе после охлаждения по данной формуле: ω2 = 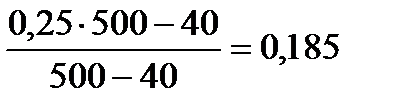
Ответ: ω2 = 0,185
6.2. Растворимость хлорида меди (II) при 200С - 73 г на 100 г воды. В насыщенном растворе при нагревании растворили еще 5 г соли, а затем охладили раствор до исходной температуры. Выделилось 7,87 г кристаллов. Определите массовую долю безводной соли в кристаллогидрате.
Дано: m(CuCl2) = 73 г на 100 г H2O Найти: ω(CuCl2)
m(CuCl2) = 5 г
m(CuCl2· 2H2O) = 7,88 г
Решение
1. Найдем массовую долю соли в исходном растворе: ω1(в-ва)= 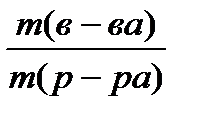 ;
;
ω1(в-ва)= 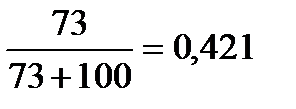 (г)
(г)
2. Найдем массу части раствора, перешедшего в кристаллогидрат:
m(р-ра) = 7,87 – 5 = 2,87 (г)
3. Найдем массу соли, содержащейся в растворе, перешедшем
в кристаллогидрат: m(в-ва) = ω · m(р-ра)
m(CuCl2) = 0,421 · 2,87 = 1,208 (г)
4. Найдем массу соли в кристаллогидрате:
m(CuCl2) = 1,208 + 5 = 6,208 (г)
5. Найдем массовую долю безводной соли в кристаллогидрате:
ω(б.с.)= 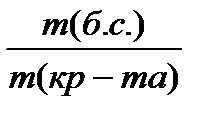 ;
;
ω(б.с.) = 6,208 / 7,87 = 0,789
Ответ: ω(CuCl2)
2 способ: 1. Найдем массовую долю соли в исходном растворе: ω1(в-ва)= 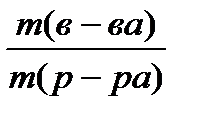 ;
;
ω1(в-ва)= 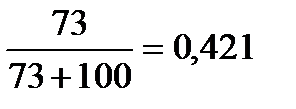 (г)
(г)
2. Найдем массу части раствора, перешедшего в кристаллогидрат:
m(р-ра) = 7,87 – 5 = 2,87 (г)
3. Примем добавленную соль за раствор с массовой долей - 1, а кристаллогидрат за раствор, полученный добавлением соли к части исходного раствора.
Составим схему:
1 ω(CuCl2) – 0,421 массовая часть соли
ω(CuCl2)
0,421 1 - ω(CuCl2) массовая часть исходного раствора,
перешедшего в кристаллогидрат
4. Найдем отношение масс добавленной соли и части исходного раствора перешедшего в кристаллогидрат:
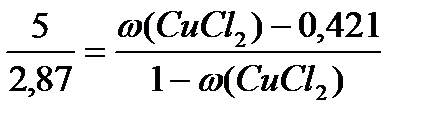 ;
;
Решив данную пропорцию получим: ω(CuCl2) = 0,789
Ответ: ω(CuCl2) = 0,789
3 способ: Решение по формуле: ω(б.с.) = 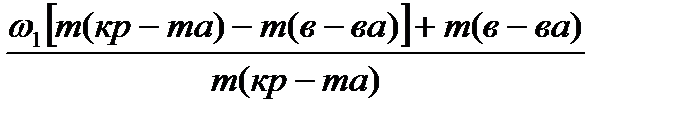
 2020-04-12
2020-04-12 173
173








