Тео
Теоретические вопросы
Государственные принципы и положения, регламентирующие качество лекарственных средств
В период существования Казахстана в составе СССР гос. контроль за качеством ЛС осуществлялся на основе стандартов и положений Гос. Русской фармакопеи, Гос. фармакопеи СССР. Последние издания ГФ СССР – 10 и 11 сохранили свой законодательный характер в республике до настоящего времени. Действует международная фармакопея, на территории РК введена приказом Комитета фармации МЗСР РК №21 с 2004 года.
Стандартами на ЛС являются ФС, ФСП, ОФС, ВФС и ТУ регламентирующие их качество, а также производственные регламенты, нормирующие их технологию производства.
Фармакопейная статья (ФС) – гос. стандарт ЛС, содержащий перечень показателей и методов контроля качества ЛС. Виды фармакопейных статей:
1). Общая фармакопейная статья (ОФС) - перечень нормируемых показателей или методов испытания для конкретной ЛФ, описание методов анализа ЛС, требования к используемым реактивам, титрованным растворам, индикаторам.
2). Фармакопейная статья (ФС) – разрабатывается на ЛС под МНН, если оно имеется и содержит обязательный перечень показателей и методов КК (с учетом ЛФ.
3). Фармакопейная статья на ЛС конкретного предприятия-производителя ЛС (ФСП) – содержит перечень показателей и методов КК ЛС производства конкретного предприятия и разрабатывается с учетом требований Гос. фармакопеи и настоящего ОСТа.
Национальные стандарты в сфере обращения ЛС:
Отраслевые стандарты серии GxP
GxP (Надлежащая … практика) - признанная во всем мире система обеспечения качества ЛС. Система GxP охватывает все этапы жизненного цикла ЛС, от фарм. разработки, испытаний, изготовления, хранения до использования конечным потребителем:
1. GLP/ Надлежащая лабораторная практика - доклинические (лабораторные) исследования
2. GCP/Надлежащая клиническая практика - клинические испытания
3. GMP/Надлежащая производственная практика - производство
4. GSP/Надлежащая практика обслуживания, хранения - хранение, которое регулируется правилами
5. GDP/Надлежащая практика оптовой продажи - оптовая торговля
6. GPP/Надлежащая практика розничной продажи - розничная торговля
Введение их в действие предусмотрено с 2008 года. Необходимость создания Гос. фармакопеи РК как собственного национального стандарта была отмечена Указом Главы государства, имеющим силу Закона, «О ЛС» 1995 года. Закон РК «О ЛС» 2004 года.
В соответствии с Законом «О ЛС» Гос. фармакопея РК – это свод гос. стандартов и положений, нормирующих качество и безопасность ЛС, зарегистрированных и разрешенных к применению в установленном порядке.
Текст ГФ РК изложен на двух языках:
1. на государственном языке – казахском;
2. на языке, официально употребляемом наравне с казахским, – русском.
Государственная фармакопея состоит из 2 томов. Первый том содержит общие фармакопейные статьи. Второй том включает частные фармакопейные статьи. Срок издания второго тома Гос. фармакопеи предусмотрен в 2009 году.
Общие фармакопейные статьи содержат наиболее общие требования на: методы испытаний; упаковочные материалы и контейнеры; реагенты; показатели качества; ЛФ; морфологически группы ЛРС; мед. иммунобиологические препараты.
Частные фармакопейные статьи регламентируют требования к показателям качества: лекарственных субстанций; вспомогательных веществ; ЛП; ЛРС; Мед. иммунобиологических препаратов.
Гос. фармакопея РК:
1. она устанавливает уровень требований к качеству и безопасности ЛС, гарантируемый государством своим гражданам;
2. требования ее являются обязательными для всех предприятий и организаций республики, занимающихся производством, изготовлением, реализацией, хранением, контролем и применением ЛС.
Источники и причины недоброкачественности лекарственных веществ
Объектами фарм. анализа являются медикаменты и лекарственное сырье, используемое для изготовления различных ЛП, от степени чистоты которого зависит качество ЛС. Качество ЛП определяется установлением его подлинности, определением его чистоты и количественным содержанием чистого вещества в препарате. Определение всех этих показателей составляет суть фарм. анализа, результаты которого для каждого отдельного препарата должны строго соответствовать требованиям Гос. фармакопеи. Почти все ЛВ содержат те или иные примеси посторонних веществ. Загрязнение ЛВ различными примесями может не только снижать его терапевтический эффект, но и вызывать нежелательное побочное действие ЛС. Особенно опасны ядовитые примеси, которые могут вызвать отравление организма.
Источником загрязнения лекарственных веществ:
1. Примеси материалов, из которых сделана аппаратура, применяемая для изготовления препарата.
2. Металлическая аппаратура (свинец (из посуды), железо, медь, иногда цинк и самая опасная примесь - мышьяк.)
3. Нарушение необходимых условий хранения лекарств.
Причины возникновения примесей в ЛВ могут быть:
1. Плохая очистка исходного сырья
2. Побочные продукты синтеза
3. Механические загрязнения (остатки фильтрующих материалов - ткань, фильтровальная бумага, асбест и т. п.)
4. Остатки растворителей (спирт, вода и др.)
Стабильность и сроки хранения лекарственных средств
Стабильность – способность ЛС сохранять свойства в определенных границах на протяжении срока годности.
Срок годности – период времени, в течение которого ЛС полностью отвечает всем требованиям НД, в соответствии с которой оно было произведено и хранилось.
Критерии стабильности ЛС:
1. Физические и химические процессы, происходящие при хранении ЛС.
2. Влияние условий получения, хранения, транспортировки на стабильность ЛС.
3. НД, определяющие условия хранения различных групп ЛВ в зависимости от их свойств и природы воздействующих факторов.
Критерии сроков хранения ЛС:
1. НД, регламентирующие сроки хранения ЛС.
2. Порядок установления сроков хранения ЛС, их научное обоснование.
3. Пути повышения стабильности ЛС.
Срок годности ЛС устанавливается экспериментально при хранении в течение определенного времени в условиях и упаковке, регламентируемых НД, он может быть изменен.
Для ЛП, произведенных путем фасовки субстанций, следует учитывать, что стабильность ЛП может зависеть от остаточного срока годности используемой субстанции.
Первоначальный срок годности ЛС определяет производитель при подготовке НД.
Для ЛП не рекомендуется устанавливать сроки годности более 5 лет, даже если результаты изучения стабильности позволяют это сделать.
Отсчет срока годности промышленной серии ЛС проводят от даты выдачи разрешения на ее реализацию (даты выпуска).
На основании изучения свойств ЛС устанавливают требования к первичной и вторичной упаковке и условиям хранения.
4. Анализ чистоты лекарственных средств. Эталонный и безэталонный методы
Анализ чистоты ЛС - неотъемлемой и важной частью КК, поскольку наличие примесей может снизить фарм. эффект, оказать противоположное действие и сделать препарат более токсичным или опасным для здоровья.
Основной принцип в требованиях к чистоте ЛС: отсутствие или ограниченное содержание примесей, которые могут отрицательно влиять на их свойства.
Примеси могут влиять на фарм. действие. Для них устанавливают предельное содержание.
Нормирование содержания примесей предусмотрено в частных статьях ГФ в разделе «Испытания на чистоту». Уровень требований к качеству ЛС зависит от технологического процесса и от способа применения ЛФ. К ЛВ, используемым в инъекционных р-рах, предъявляются дополнительные требования в отношении качества.
Источником загрязнения лекарственных веществ:
4. Примеси материалов, из которых сделана аппаратура, применяемая для изготовления препарата.
5. Металлическая аппаратура (свинец (из посуды), железо, медь, иногда цинк и самая опасная примесь - мышьяк.)
6. Нарушение необходимых условий хранения лекарств.
В частной статье на каждое ЛС приведен перечень показателей, по которым устанавливается его чистота. Несоответствие ЛВ хотя бы одному из предусмотренных показателей указывает на изменение его качества, наличие или появление примесей в процессе хранения.
2 метода определения предела содержания примесей в ГФ: безэталонный и эталонный.
1. Безэталонный метод
В случаях, когда в частной ФС на ЛВ указано, что примеси «не должно быть», проводится испытание на эту примесь; положительным результатом будет их отсутствие в ЛВ.
Отрицательная реакция на определяемую примесь может означать, что чувствительность реакции недостаточна для определения данной примеси, т.е. говорить о полном отсутствии данной примеси нельзя.
2. Эталонный метод
Используется если предел содержания примесей дан в числовом выражении (в %).
Для определения допустимого предела содержания примесей в ЛС проводят их количественную оценку с помощью эталонных растворов - на цветность, мутность, примесные вещества и ионы. Эталонные растворы содержат определенное количество примеси. Сравнение проводят колориметрическим (определение окраски) или нефелометрическим (определение мутности) методом.
Эталонные растворы готовят из соответствующих веществ, взятием точной навески. Эталонный метод более точен, чем безэталонный, поэтому часто используется для нормирования содержания токсичных примесей (примеси мышьяка, тяжелых металлов и др.).
Допустимое количество примесей в ЛВ может быть определено также путем титрования, хроматографическим методом, колориметрическим, спектрофотометрическим и др.
Для определения примесей хим. реакциями используются специфические и высокочувствительные реакции.
При испытании на чистоту должны соблюдаться требования ГФ:
1. Вода и реактивы должны быть свободны от ионов, на которые проводится испытание.
2. Пробирки, в которых проводятся наблюдения, должны быть бесцветными и одинакового диаметра.
3. Добавление реактивов к испытуемому и эталонному растворам должно проводиться одновременно и в одинаковых количествах.
4. Когда в статье ГФ указано, что в данной концентрации раствора не должно обнаруживаться той или иной примеси, к испытуемому раствору прибавляют применяемые для каждой реакции, приведенные в статье реактивы, кроме основного, открывающего данную примесь. Раствор делят на 2 равные части и к одной из них прибавляют основной реактив. Оба раствора сравнивают. Между ними не должно быть различий.
5. Окраску сравнивают при дневном отраженном свете на матово-белом фоне. Степень мутности определяют, сравнивая пробирки в проходящем свете на темном фоне.
5. Препараты моноциклических терпенов – ментол, валидол, терпингидрат. Методы анализа, применение, хранение
Производные ментана:
1. Ментол (Mentholum)
 Описание: Кристаллический порошок сыпучий, призматические или игольчатые бесцветные блестящие кристаллы.
Описание: Кристаллический порошок сыпучий, призматические или игольчатые бесцветные блестящие кристаллы.
Растворимость. Очень легко растворим в 96% спирте, эфире и эфире, легко растворим в жирных маслах и вазелиновом масле, очень мало растворим в глицерине.
Плавится при температуре около 34°С.
Подлинность. 1). Ментол и валидол - цветная реакция с конц. серной кислотой в присутствии ванилина. Появляется желтое окрашивание, которое при добавлении воды переходит в малиново-красное:
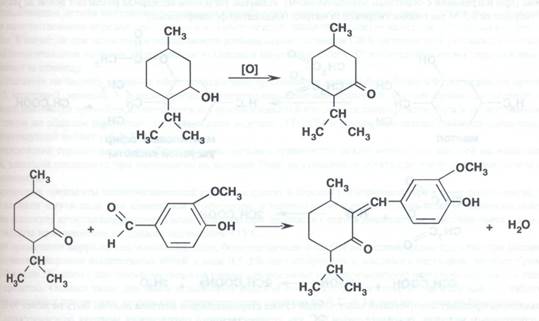
2). Ментол + о-фталевый ангидрид; в присутствии конц. серной кислоты = оранжево-красное окрашивание.
3). Спиртовый р-р фурфурола + ментол и конц. серной кислотой = фиолетовая окраска.
4). Бензольный р-р оксихинолината ванадия + ментол = красный окрас при нагревании
Количественное определение. 1). Ацетилирование уксусным ангидридом в среде безводного пиридина. Избыток уксусного ангидрида разлагают водой до уксусной кислоты и титруют ее 0,5 М р-ром гидроксида натрия (индикатор фенолфталеин):

2). Газо-жидкостная хроматография.
2. Валидол (Validolum)
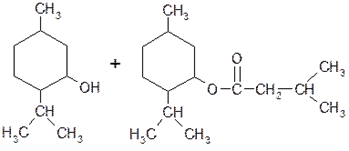
Количественное определение. В валидоле количественно определяют содержание ментилового эфира изовалериановой к-ты, омыляя его 0,5 М спиртовым р-ром гидроксида калия (кипятят 5 ч):

 2020-04-12
2020-04-12 648
648







