Процесс получения антибиотика включает в себя стадии:
1. получение соответствующего штамма — продуцента антибиотика, пригодного для промышленного производства;
2. биосинтез антибиотика;
3. выделение и очистка антибиотика;
4. концентрирование, стабилизация антибиотика и получение готового продукта.
Первая задача при поиске продуцентов антибиотиков - выделение их из природных источников. Биосинтез антибиотиков - наследственная особенность организмов, проявляющаяся в том, что каждый вид (штамм) способен образовывать один или несколько вполне определенных, строго специфичных для него антибиотических веществ.
Выявление потенциальной возможности образовывать в процессе жизнедеятельности антибиотики связано с условиями культивирования организмов. В одних условиях организм образует антибиотик, в других условиях тот же организм при хорошем росте не будет обладать способностью синтезировать антибиотическое вещество. Образование антибиотиков будет происходить только при развитии организма в специфической среде и при наличии особых внешних условий. Путем изменения условий культивирования можно получить больший или меньший выход антибиотика, или создать условия, при которых антибиотик вообще не будет образовываться. Можно также путем изменения условий культивирования продуцента добиться преимущественного биосинтеза одного из антибиотиков, при условии образования изучаемым организмом нескольких антибиотических веществ, или же получить новые формы антибиотиков, но только в пределах тех соединений, которые способны синтезироваться этим организмом.
К числу наиболее существенных факторов, оказывающих влияние на проявление антибиотических свойств микроорганизмов, относятся состав среды, ее активная кислотность, окислительно-восстановительные условия, температура культивирования, методы совместного выращивания двух или большего числа микроорганизмов и другие факторы.
Среды для культивирования микроорганизмов. Натуральные (комплексные) среды, состоящие из природных соединений и имеющие неопределенный химический состав (части зеленых растений, животные ткани, солод, дрожжи, фрукты, овощи, навоз, почва и т. д.), содержат все компоненты, необходимые для роста и развития микроорганизмов большинства видов. Используются следующие среды:
- мясопептонная среда, в состав которой одновременно с мясным экстрактом и пептоном входят хлорид натрия, фосфат калия, иногда глюкоза или сахароза; используется обычно в лабораторной практике.
- картофельные среды с глюкозой и пептоном, часто используемые в лаборатории для культивирования многих видов актиномицетов и бактерий;
- среды с кукурузным экстрактом, соевой мукой, бардой и другими веществами, в состав которых входят сульфат аммония, карбонат кальция, фосфаты, глюкоза, сахароза, лактоза или иные углеводы и ряд других соединений; среды успешно применяются в промышленности, т. к. являются дешевыми и обеспечивают хорошее развитие микроорганизмов с высоким выходом антибиотиков.
Обычно наиболее благоприятным для микроорганизмов является соотношение C/N = 20. Однако для образования антибиотика такое соотношение не всегда оптимально. Поэтому для каждого продуцента необходимо подбирать соответствующее соотношение углерода и азота.
Источниками минерального питания служат фосфор, сера и другие макро- и микроэлементы.
Продуценты антибиотиков по отношению к концентрации фосфора в среде можно разделить на три группы:
- высокочувствительные продуценты, для которых оптимальная концентрация фосфора в среде составляет менее 0,01 % (продуценты нистатина, тетрациклинов, флоримицина, ванкомицина);
- продуценты средней чувствительности, для которых оптимальная концентрация фосфора составляет 0,010–0,015 % (продуценты стрептомицина, эритромицина, циклосерина, неомицина);
- малочувствительные продуценты, для которых оптимальная концентрация фосфора составляет 0,018–0,020 % (продуценты новобиоцина, грамицидина, олеандомицина).
Сера входит в состав некоторых антибиотиков, образуемых грибами (пенициллин, цефалоспорин, глиотоксин и др.), бактериями (бацитрацины, субтилины, низины) и актиномицетами (эхиномицины, группа тиострептона). Обычно источником серы в среде служат сульфаты. Однако при биосинтезе пенициллина лучшим источником серы для продуцента служит тиосульфат натрия.
Кроме того, для биосинтеза антибиотиков необходимы и отдельные микроэлементы. Так, продуцент альбомицина S. subtropicus образует антибиотик при значительной концентрации железа в среде. Железо необходимо для образования хлорамфеникола и других антибиотиков.
Биосинтезу ряда антибиотических веществ (хлорамфеникола, стрептомицина, пенициллина и др.) способствуют ионы цинка.
Стимулирующее влияние на биосинтез гентамицина, курамицина А, фософономицина оказывают ионы кобальта.
Ионы галогенов входят в состав некоторых тетрациклиновых антибиотиков и хлорамфеникола.
Влияние рН среды. Многие бактериальные организмы, синтезирующие антибиотики, лучше развиваются при рН около 7,0, хотя некоторые, например молочнокислые стрептококки, продуцирующие низин, лучше развиваются в среде при рН = 5,5÷6,0.
Большинство актиномицетов хорошо развиваются при начальных значениях рН среды в пределах от 6,7 до 7,8; в большинстве случаев жизнеспособность актиномицетов при рН ниже 4,0–4,5 подавлена.
Температура. Для большинства бактериальных организмов температурный оптимум развития лежит в диапазоне 30–37 °С. Для продуцента грамицидина С оптимальная температура для развития и биосинтеза равна 40 °С.
Актиномицеты, как правило, культивируются при температуре 26–30°С, хотя некоторые виды стрептомицетов могут развиваться как при пониженных (от 0 до 18 °С), так и при повышенных (55–60 °С) температурах.
Для большинства мицелиальных грибов оптимальная температура составляет 25–28 °С.
Аэрация. Большинство изученных продуцентов антибиотиков являются аэробами. Для биосинтеза многих антибиотиков (пенициллин, стрептомицин и др.) максимальное их накопление происходит при степени аэрации, равной единице, при которой через определенный объем среды за 1 мин продувается такой же объем воздуха.
В процессе развития продуцента антибиотика в промышленных условиях потребность организма в кислороде меняется в зависимости от стадии развития, вязкости культуральной жидкости и других факторов. На определенных стадиях могут возникнуть ситуации, связанные с кислородным голоданием продуцента. В этих условиях следует принимать дополнительные меры, например, повышение концентрации окислителя добавлением пероксида водорода.
Наиболее перспективным методом выращивания микроорганизмов - продуцентов антибиотиков признан метод глубинного культивирования с использованием периодических процессов. В условиях глубинной культуры процесс развития организма и синтеза антибиотика проходит в две фазы.
В первой фазе развития культуры или, как ее иногда называют, тропофазе (фаза сбалансированного роста микроорганизма), наблюдается интенсивное накопление биомассы продуцента, связанное с быстрым потреблением основных компонентов среды и с высоким уровнем поглощения кислорода.
Во второй фазе развития, именуемой идиофазой (фаза несбалансированного роста микроорганизма), накопление биомассы замедлено или даже уменьшено. В этот период продукты метаболизма микроорганизма лишь частично используются на построение клеточного материала, они в основном направляются на биосинтез антибиотика. Обычно максимум продукции антибиотика в среде наступает после максимума накопления биомассы. Подробное описание технологического процесса на примере производства пенициллина приведено в следующей главе.
Антибиотики должны отвечать следующим требованиям:
— быть активными в отношении одного или нескольких патогенных микроорганизмов;
— хорошо всасываться и распределяться в организме, то есть достаточно долго сохраняться в очаге инфекции в концентрациях, превышающих минимально подавляющие концентрации (МПК);
— быть нетоксичными, не проявлять отрицательного побочного действия.
9. Методы оценки качества антибиотических лекарственных средств
Качественное определение.
Задача качественно анализа определить неизвестный антибиотик встаёт как при изучении новых антибиотиков, так и в практике, если нужно показать присутствие антибиотика в фармацевтических препаратах. Обе задачи требуют совершенно различных методов. Самым надёжным методом идентификации антибиотика является определение его инфракрасного спектра. Результаты здесь абсолютно однозначны. Только после измерения инфракрасного спектра можно с полной уверенностью судить об отличии или идентичности двух антибиотиков различного происхождения. Поскольку инфракрасным спектрофотометром оснащена не каждая лаборатория, то для идентификации антибиотиков были разработаны системы простых химических реакций, довольно надёжных для идентификации известных антибиотиков.
Для быстрого качественного определения антибиотиков в фармацевтических препаратах очень удобна осциллографическая полярография. При хорошо подготовленной аппаратуре можно за несколько минут идентифицировать большинство применяемых антибиотиков. Практически наиболее важным являются разграничение тетрациклиновых антибиотиков от хлорамфеникола, а также проверка состояния и чистоты пенициллиновых препаратов, причём важно быстро установить, до какой степени препарат разложился.
Другим быстрым физическим методом идентификации антибиотиков является определение показателя преломления твёрдого вещества.
В процессе производства требуется определить содержание антибиотика в культуральной жидкости в ходе ферментации, во всех промежуточных продуктах при выделении и очистке и, наконец, в готовом препарате. Для этого применяют большое количество самых разнообразных биологических и химических методов
Химические методы.
Химические методы используются для анализа антибиотиков очень редко. Практически это будет лишь несколько методов, применяемых для пенициллина. Они основаны на поглощении йода продуктами гидролиза пенициллина. Эти методы в различных модификациях применяются в практике при контроле ферментации и экстракции пенициллина. При более старом способе с применением щелочного гидролиза необходимо было экстрагировать пенициллин из культуральной жидкости амилацетатом при рН=2,0 и температуре 0є, затем из амилацетата экстрагировать его фосфатным буфером при рН=7,8 и только с этим экстрактом производить непосредственное йодометрическое определение. Более новый метод, про котором пенициллин разрушается кислотой, позволяет проводить работу прямо с культуральной жидкостью без экстракций.
Пенициллин можно определять также ацидометрически после его расщепления до пенициллоиновой кислоты, при этом из в-лактамного кольца пенициллина освобождается одна свободная карбоксильная группа, которую можно титровать; в-лактамное кольцо пенициллина можно расщепить либо щёлочью, либо пенициллиназой. Этот метод, однако, нельзя применять для нативного раствора, который содержит множество посторонних веществ, делающих точное ацидометрическое титрование невозможным.
Оптические методы. Колориметрия и спектрофотометрия в видимом свете.
Сюда относятся наиболее часто применяемые методы количественного определения антибиотиков. Основным достоинством колориметрических методов определения являются их простота, скорость и сравнительно высокая точность, недостатком? их малая специфичность.
Для колориметрического определения антибиотики превращают в окрашенные производные. При этом используют цветные реакции либо с самими антибиотиками, либо с продуктами их расщепления. Например, тетрациклиновые антибиотики образуют окрашенные комплексы с хлорным железом в кислой среде. Стрептомицин расщепляют едким натром до мальтола, который даёт цветную реакцию с хлорным железом или с реактивом Фелинга. Антибиотики группы фенола или ароматических аминов со свободным орто- или пара-положением можно обычно перевести в азокрасителе путём реакции с диазониевыми солями. Так можно определять, например, тетрациклиновые антибиотики.
Некоторые антибиотики можно перевести в соединения с каким-либо красителем, затем выделить эти вещества из реакционной смеси и определить колориметрически. Так можно определять пенициллин с помощью N-(1-нафтил-4-азобензол)-этилендиамина.
Спектрофотометрия в ультрафиолетовом свете
Спектральный анализ имеет большие возможности, нежели колориметрия. Большинству антибиотиков свойствен характерный спектр поглощения в ультрафиолетовой области, и поэтому определять их спектрофотометрически можно непосредственно. Недостатком является то, что присутствие посторонних веществ мешает определению в значительно большей мере, нежели при колориметрии или спектрофотометрии в видимом свете, и поэтому определять антибиотики этим методом можно лишь в отдельно чистых образцах.
Можно повысить специфичность метода и сделать его применимым к менее чистым препаратам путём измерения экстинкции при двух различных длинах волн, из которых одна находится на максимуме, а другая? при соседнем минимуме кривой экстинкции антибиотика. Этим путём зачастую удаётся установить влияние среды. Важно, чтобы все измерения проводились при строго определённом рН, поскольку спектр поглощения антибиотика в ультрафиолетовом свете очень сильно зависит от рН среды.
Этот метод является специфичным для качественного определения антибиотика. Его можно, однако, очень хорошо использовать и для количественного определения. Обычно достигается точность, равная точности спектрофотометрии в ультрафиолетовом свете, а в некоторых случаях даже ещё более высокая (±1%). Можно производить количественный анализ как растворов, так и твёрдых веществ. При анализе веществ в растворах необходимо выбрать подходящий растворитель, который сам бы не поглощал инфракрасные лучи в данной области. Обычно это бывает сероуглерод или же галоидопроизводные углеводородов. Поэтому антибиотик нужно иметь в такой форме, чтобы его можно было в этих веществах растворить. Если же подходящий растворитель найти не удаётся, можно провести спектрофотометрическое определение вещества в твёрдом состоянии. Твёрдые вещества либо таблетируют с бромистым натрием. Либо суспендируют в масле: измерение поглощения производят в тонких слоях этой суспензии.
Для количественного определения необходимо знать плотность слоёв этой суспензии. Её определяют путём добавления известного количества кристаллического вещества, например б-аланина, к суспензии антибиотика и измерения экстинкции при одном из максимумов поглощения добавленного вещества.
Флюорометрия.
Это один из наиболее чувствительных методов определения антибиотиков, приближающийся по своей чувствительности к биологическим методам. Главной областью его применения являются тетрациклиновые антибиотики, которые сами по себе флюоресцируют жёлтым светом в умеренной щелочной среде; однако обычно измеряется синяя флюоресценция их продуктов разложения в щелочной среде. Хлортетрациклин инактивируют щелочами, например 0,2 М тринатрийфосфатом, оставив смесь стоять в течение 30 минут при комнатной температуре, в то время как тетрациклин кипятят при этом в течение более продолжительного времени.
Антибиотики, которые сами по себе не флюоресцируют и не образуют флюоресцирующих продуктов разложения, можно тем не мене определять флюорометрически путём соединения с подходящим флюоресцирующим веществом и выделения подходящего дополнительного соединения.
Оптическое вращение.
Поляриметрические методы дают очень надёжные результаты применительно к концентратам оптически активных антибиотиков, если только они не слишком сильно окрашены. Вследствие удобства работы они получили очень широкое применение как обычные методы контроля, в особенности при выделении стрептомицина. Для определения антибиотиков в культуральной жидкости они непригодны, поскольку в этих случаях они малочувствительны.
Сконструирован автоматический регистрирующий поляриметр, при помощи которого изучена кинетика разрушения пенициллина кислотами.
Электрохимические методы.
Антибиотики, являющиеся кислота или основаниями, можно титровать потенциометрически. Эти методы применяют сравнительно редко, поскольку с такими антибиотиками редко приходится иметь дело в этих формах. Исключение составляет, например, пенициллин.
Хлоргидраты тетрациклиновых антибиотиков имеют сильно кислотные свойства, напротив, основность этих антибиотиков очень слаба. Поэтому хлоргидраты можно титровать непосредственно алкалиметрически. После подтитровки хлоргидрата достижения степени диссоциации свободной амфотерной формы антибиотика на кривой потенциометрического титрования можно ясно видеть резкое изменение потенциала.
Намного большую точность и значительно более широкие возможности имеет потенциометрическое титрование в неводных растворителях. Так, например, слабоосновные антибиотики, как тетрациклины, а также эритромицин и карбомицин, можно определять с помощью титрованного раствора хлористой кислоты в диоксане. Напротив, антибиотики с кислотными свойствами, пусть даже и очень слабыми, удаётся титровать в среде безводных оснований, например, в триэтаноламине.
Эти методы выгодны тем, что они являются универсальными для целой группы антибиотиков. Конечно, они могут применяться исключительно лишь для чистых веществ и готовых препаратов.
Полярография.
Антибиотики, содержащие в своей молекуле восстанавливающиеся группы например, нитрогруппы, кетогруппы, примыкающие к одной или более двойной связи, альдегидные группы, карбоксильные группы, примыкающие к двойным связям либо имеющие хиноподобную структуру, могут быть восстановлены на ртутном капельном электроде и могут поэтому определяться полярографически. Сюда относятся прежде всего хлорамникол, далее? все тетрациклиновые антибиотики, стрептомицин, все хиноновые антибиотики, цитринин.
Другие антибиотики, напротив, окисляются на ртутном капельном электроде и могут поэтому давать анодную волну, которая также может служить для их количественного определения. Примером является гентизиловый спирт, производное гидрохинона.
Антибиотики, которые сами по себе полярографически неактивны, можно перевести несколькими способами в полярографически активные вещества. Так, например, пенициллин гидролизуется сначала щёлочью или пенициллиназой и далее в кислой среде? до диметилцистеина. Эта аминокислота, содержащая группу? SH, даёт хорошо измеряемую волну в кобальтовом растворе Брдички.
Очень ценна с аналитической точки зрения полярография хлорамникола. Этот антибиотик можно количественно определять полярографическим методом в биологическом материале, как-то: в крови и моче человека, в кутьтуральной жидкости.
Следующей областью применения полярографии являются тетрациклиновые антибиотики. Их можно определять количественно в готовых продуктах и в фармацестических препаратах. При соответствующем выборе среды можно определять количественно соотношение хлортетрациклина и окситетрациклина. Однако количественный анализ смеси хлортетрациклин и окситетрациклина лучше всего удаётся колориметрическим методом. В культуральной жидкости тетрациклиновые антибиотики определить нельзя, поскольку в этом случае определению мешает выделение водорода, катализируемое белками и другими веществами, присутствующими в фильтрате культуральной жидкости.
10. Антибиотики – тетрациклины. Общая характеристика, требования к качеству, методы анализа
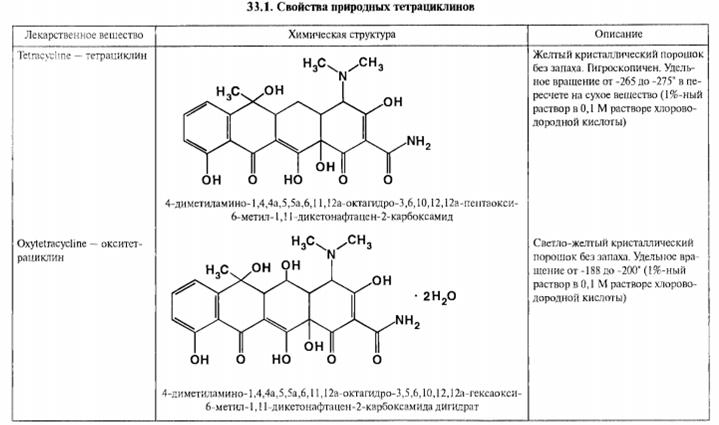
Природные тетрациклины. К этой группе относятся полиоксиполикарбонильные соединения, основой химической структуры которых является частично гидрированный цикл тетрацена (нафтацена):
В медицине применяют тетрациклин и окситетрациклина дигидрат.
Тетрациклин был получен в 1953 г. путем каталитического гидрирования хлортетрациклина, впервые выделенного из почвы в 1948 г. М. Дуггаром.
Окситетрациклин отличается от тетрациклина наличием гидроксида в положении 5, поэтому их общая формула имеет вид
Для получения природных антибиотиков тетрациклинового ряда используют микроорганизмы Streptomyces aureofaciens и Streptomyces rimosus.
По физическим свойствам природные тетрациклины - кристаллические вещества желтого или светло-желтого цвета, без запаха. Растворы в хлороводородной кислоте вращают плоскость поляризованного света влево, поэтому удельное вращение является одной из физических констант, подтверждающих подлинность.

Tetracycline- тетрациклин.

Oxytetracycline - окситетрациклин.
Тетрациклин и окситетрациклина дигидрат являются основаниями, поэтому тетрациклин очень мало растворим, а окситетрациклин практически нерастворим в воде; оба умеренно растворимы в этаноле. В воде и этаноле тетрациклин растворяется медленно. В хлороформе и эфире они практически нерастворимы или мало растворимы. Тетрациклин и окситетрациклина дигидрат легко растворимы в разведенных кислотах и щелочах, т.к. являются амфотерными соединениями. Обладают основными свойствами, обусловленными наличием в молекуле диметиламиногруппы, и поэтому вступают во взаимодействие с органическими и неорганическими кислотами, образуя непрочные соли. Проявляют кислотные свойства за счет фенольных и енольных гидроксилов и дают соли с гидроксидами щелочных металлов. Образуют нерастворимые внутрикомплексные соединения с полизарядными катионами (кальция, магния, алюминия, железа, меди).
Указанные химические свойства лежат в основе испытаний доброкачественности тетрациклинов.
В качестве общих реактивов на тетрациклины используют соли меди, цинка, образующие окрашенные комплексы «разбавленную хлороводородную кислоту, в присутствии которой растворы тетрациклинов приобретают желтое окрашивание с зеленоватым, тетрациклин оттенком или оранжево-красную окраску окситетрациклин.
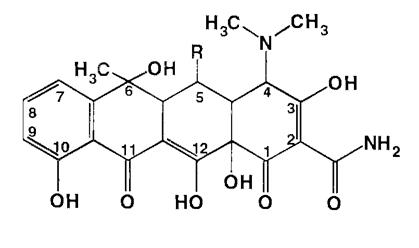
Подлинность тетрациклинов устанавливают с помощью цветных реакций. Реактивом, позволяющим отличать антибиотики друг от друга, является концентрированная серная кислота, под действием дегидратирующего воздействия которой образуются окрашенные ангидропроизводные:

В среде концентрированной серной кислоты ангидропроизводные тетрациклина окрашиваются в фиолетовый цвет, тетрациклина - в пурпурно-красный. При последующем добавлении к окрашенному раствору тетрациклина хлорида железа (III) фиолетовая окраска переходит в коричневую или красно-коричневую, окситетрациклина дигидрат по действием хлорида железа (III) в спиртовой среде приобретает коричневую окраску.
Окрашивание продуктов обусловлено наличием фенольных гидроксилов в молекулах.
Способность тетрациклинов окисляться с образованием окрашенных продуктов позволяет использовать для их идентификации такие окислители, как хлорамин Б, селенистая кислота, нингидрин в различных растворителях. Указанные реактивы позволяют идентифицировать тетрациклины и отличать их друг от друга.
Известны также цветные реакции на антибиотики этой группы с нитропруссидом натрия, диметиламинобензальдегидом, реактивом Несслера. Наличие в молекулах фенольных гидроксилов обусловливает образование имеющих красное окрашивание азокрасителей при взаимодействии с различными диазосоединениями, которые присоединяются в положен 9.
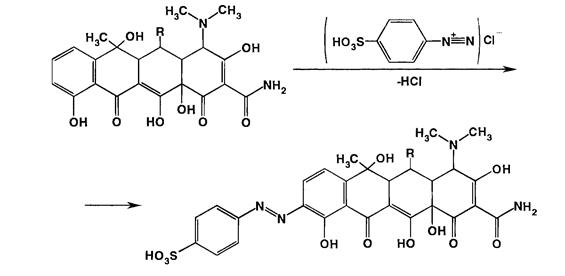
Для качественного анализа антибиотиков тетрациклинового ряда используют также их способность образовывать в определенных условиях флуоресцирующие продукты. Так, при действии раствором гидроксида натрия происходит изомеризация с образованием изотетрациклина, имеющего голубую флуоресценцию в УФ-свете после нагревания в кипящей водяной бане.
Тетрациклин и окситетрациклин имеют в молекулах по две системы сопряженных связей и поэтому характеризуются наличием двух полос электронного поглощения. Для аналитических целей представляет интерес длинноволновая полоса, обусловленная присутствием в молекулах карбонильных групп. Удельный показатель поглощения раствора тетрациклина при длине волны 380 нм должен быть равен 380-419,раствор сравнения - 0,1 М хлороводородная кислота. Подлинность окситетрациклина подтверждают по величине оптической плотности 0,002%-ного раствора в хлороводородной кислоте при длине волны 353 нм.
Подлинность тетрациклинов по ФС и МФ подтверждают, используя метод ТСХ. Тетрациклин растворяют в метаноле и хроматографируют относительно стандартных образцов на пластинках с закрепленным слоем силикагеля марки КСК 2,5 или пластинках «Сорбфил» в системе ацетон -- вода (10:1,4). Для окситетрациклина используют систему этилацетат - ацетон - вода (20:19:1). После высушивания пластинку выдерживают в парах аммиака и просматривают в УФ-свете 366 нм. Зоны испытуемых и стандартных образцов должны быть идентичными.
При выполнении испытаний начистоту по ФС в тетрациклине устанавливают спектрофотометрическим методом присутствие светопоглощающих примесей при длине волны 430 нм. Величина оптической плотности должна быть не более 0,5. При аналогичном испытании 0,2%-ного раствора окситетрациклина оптическая плотность при 430 нм должна быть не более 0,25, а при 490 нм - не более 0,2. Методом ТСХ подобно испытанию подлинности обнаруживают присутствие специфических примесей. Указанные примеси ФС рекомендует устанавливать также методом ВЭЖХ. Методом ГЖХ определяют содержание остаточных растворителей (метанола, изооктанола).
Тетрациклин количественно определяют методом неводного титрования 0,1 М раствором хлорной кислоты. Титруют в смеси муравьиной, ледяной уксусной кислоты и диоксана (5:10:10). Эквивалентную точку устанавливают потенциометрически.
Сравнительные исследования показали сопоставимые результаты при количественном определении окситетрациклина на биологическим и дифференциальным спектрофотометрическим методами. В качестве растворителя использован 0,01 М раствор хлороводородной кислоты, аналитическая длина волны 353 нм Разработана также методика дифференциального фотоколориметрического определения тетрациклина гидрохлорида с использованием в качестве реактива хлорамина Б в щелочной среде.
Биологическую активность тетрациклиновых антибиотиков определяют способом диффузии в агар с тест-культурой,Р Bacillus siibtilis (ГФ XI, вып. 2, с. 210). Один мнкрограмм химически чистого лекарственного вещества соответствуе цнфпческой активности, равной одной единице действия. Следовательно, 1,0 г соответствует 1 000 000 ЕД.
Оценку биологической активности природных тетрациклинов можно также осуществить методом обратной тур° метрии с тест-культурой Staphylococcus aureus 209 Р. Степень мутности измеряют на фотоэлектроколориметре со светофильтром №7 582 нм.
Применяют так же способы фотоколориметрического определения, основанные на использовании цветных реакций с раствором хлорида железа (III), с диазосоединениями, хлорамином Б в щелочной среде и другими реактивами. Известны способы флуорометрического определения.
Лекарственные препараты тетрациклинов хранят по списку Б, в сухом, защищенном от света месте, при комнатной температуре. Упаковывают в стеклянные, хорошо укупоренные банки оранжевого стекла с навинчивающимися крышками залитыми парафином, или в другую подходящую тару. При хранении тетрациклина и окситетрациклина наблюдается изменение окраски. На свету они темнеют. Это является следствием образования примеси 4-эпитетрациклина, ангидротетрациклина, 4-эпиангидротетрациклина и продуктов дальнейшего превращения. Указанные вещества отличаются меньшей биологической активностью и более высокой токсичностью, чем исходные лекарственные вещества.
В растворах кислот и щелочей,особенно при нагревании, тетрациклин и окситетрациклин легко разрушаются. Инактивация щелочных растворов обусловлена образованием изотетрациклиновых производных. Например, тетрациклин превращается изотетрациклин.

Идентичные продукты образует окситетрациклин.
Тетрациклин и окситетрациклин -- антибактериальные средства. Их механизм действия основан на подавлении биосинтеза белка микробной клетки. Применяют при пневмонии, бактериальной и амебной дизентерии, коклюше, гонорее, бруцеллезе, туляремии, сыпном и возвратном тифе и других инфекционных заболеваниях внутрь в виде таблеток, капсул, суспензии по 0,1-0,2-0,3 г 3-5 раз вдень. Наружно назначают 1-3%-ные мази для лечения глазных заболеваний, ожогов, флегмон.
Полусинтетичесгсие тетрациклины.
Одним из недостатков природных тетрациклинов является сравнительно высокая токсичность. В результате исследований, проведенных в нашей стране и за рубежом, созданы полусинтетические аналоги природных тетрациклинов: доксициклин (вибрамицин), метациклин (рондомицин) и др.
Общая формула полусинтетических тетрациклинов:

Производные 6-дезокситетрациклина получают из окситетрациклина, изменяя структуру молекулы в положении 6. Дезоксилирование приводит к образованию доксициклина (6-дезокси-5-окситетрациклина), а последующее превращение метильной группы в метиленовую дает возможность получить метациклин (6-дезокси-6-деметил-6-метилен-5-окситетрациклин):
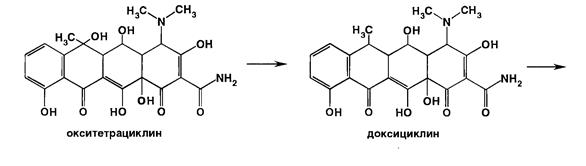

Способы испытаний на подлинность, чистоту и количественная оценка синтетических и природных тетрациклинов во многом сходны.

Doxycycline Hydrochloride - доксициклина гидрохлорид.
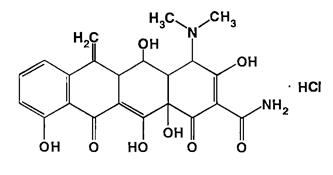
Methacycline Hydrochloride - метациклина гидрохлорид.
Доксициклина гидрохлорид легко, но медленно растворим в воде 1:3, легко растворим в метаноле 1:4 и мало -в этаноле. Метациклина гидрохлорид трудно и медленно в течение 40 мин растворим вводе 1:80 и в метаноле 1:40. В эфире и хлороформе оба практически нерастворимы.
Подлинность лекарственных веществ устанавливают по ИК-спектрам, сравнивая их со спектрами стандартных образцов. Методом УФ-спектрофотометрии подлинность подтверждают по удельному показателю поглощения, который у доксициклина гидрохлорида 280-310 устанавливают при длине волны 349 нм, растворитель - смесь 1 М раствора хлороводородной кислоты и метанола 1:99, а у метациклина гидрохлорида при 345 нм. УФ-спектр раствора метациклина гидрохлорида в области 220-400 нм в том же растворителе имеет максимумы поглощения при 253 и 345 нм и минимумы при 223 и 299 нм. При длине волны 345 нм со стандартным раствором устанавливают относительную оптическую плотность метациклина, которая должна быть равна от 96 до 104%.
Доксициклин и метациклин дают цветные реакции с серной кислотой желтое окрашивание и хлоридом железа (Ш), темное красно-коричневое окрашивание. Они дают также положительную реакцию на хлориды. Для установления подлинности и испытаний на наличие специфических примесей применяют метол ТСХ. аналогично испытаниям природных тетрациклинов.
Испытывают на наличие светопоглощающих примесей, измеряя оптическую плотность 1%-ных растворов полусинтетических тетрациклинов в смеси хлороводородной кислоты и метанола 1:99. Она должна быть не более 0,1. Методом ГЖХ в доксициклина гидрохлорида устанавливают наличие примеси этанола, методом К. Фишера - воды. В метациклине гидрохлориде меркуриметрическим методом количественно определяют содержание хлоридов не менее 7,0% и не более 7,8%; в качестве индикатора используют раствор дифенилкарбазона.
Биологическую активность препаратов определяют методом диффузии в агар с тест-культурой Bacillus subtilis.
Хранят лекарственные препараты полусинтетических тетрациклинов по списку Б, в сухом, защищенном от света месте, при комнатной температуре. Даже в темноте, особенно во влажной атмосфере и при повышении температуры, они постепенно разлагаются. Выпускают в капсулах- доксициклина гидрохлорида 0,05, 0,1 и 0,2 г, метациклина гидрохлорида по 0,15 и 0,3 г. Показания для применения у полусинтетических тетрациклинов те же, что и у природных, но вследствие лучшей растворимости они быстрее всасываются, дольше сохраняются до 24 ч в крови, а также отличаются меньшей токсичностью.
 2020-04-12
2020-04-12 1041
1041








