При разработке технологических процессов на основе обратимых химических реакций прежде всего необходимо установить, какие реакции будут протекать при переработке сырья и насколько глубоко проходит основная реакция обеспечивающая получение целевого продукта, т.е. каков максимальный равновесный выход целевого процесса.
Из курса «Физическая химия» известно, что, определяя изменение изобарно-изотермического потенциала G (энергии Гиббса) для реакций, которые протекают в рассматриваемом процессе, и сравнивая их, устанавливают термодинамически наиболее вероятную реакцию.
Далее слайд2.10:
Изменение изобарно-изотермического потенциала ∆G либо рассчитывают, либо определяют на основе экспериментальных данных.
Для расчета ∆G используют уравнение
 , ,
| (2.10) |
где ν i и ν j – стехиометрические коэффициенты в уравнении химической реакции исходных и конечных веществ; ∆G0 – изменение изобарно-изотермического потенциала компонента реакции.
Из уравнения (2.10) видно, что величина 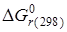 представляет собой разность между изменениями изобарно-изотермических потенциалов при образовании из простых веществ конечных продуктов и исходных реагентов. Например, для реакции:
представляет собой разность между изменениями изобарно-изотермических потенциалов при образовании из простых веществ конечных продуктов и исходных реагентов. Например, для реакции:

из уравнения (2.10) следует:
 . .
| (2.11) |
Изменение энергии Гиббса реакции можно так же рассчитать, опираясь на экспериментально найденные значения  :
:
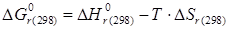 , ,
| (2.12) |
где  - тепловой эффект реакции при Т=298К;
- тепловой эффект реакции при Т=298К;  - изменение энтропии реакции при Т=298К. слайд№2.10 до.
- изменение энтропии реакции при Т=298К. слайд№2.10 до.
далее слайд2.11:
Значение ∆S находят по разности между энтропией конечных продуктов и исходных веществ
 . .
| (2.13) |
Для реакции ν АА+ ν ВВ = ν СС+ ν NN уравнение (2.13) принимает вид
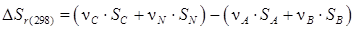 . .
| (2.14) |
Для всех веществ, часто встречающихся в химической промышленности, значения ∆ H, ∆ S, ∆ G приводятся в справочной литературе.
 2020-04-12
2020-04-12 284
284








