Селективность необратимых химических процессов.
Химические реакции, реализуемые в промышленности, в большинстве своем являются необратимыми и, следовательно, основным критерием их осуществления является скорость химической реакции, которая непосредственно связана с экономической эффективностью всего химического производства.
Как уже отмечалось скорость химической реакции при V=const выражается уравнением:
 . .
| (2.1) |
В этом уравнении k – константа скорости химической реакции, которая связана с температурой химического процесса уравнением Аррениуса
 , ,
| (2.2) |
где k0 – предэкспоненциальный множитель; E – энергия активации; R – универсальная газовая постоянная; Т – температура процесса.
Подставив значение k из уравнения (2.2) в (2.1) получим полное кинетическое уравнение
 . .
| (2.3) |
Из этого уравнения следует, что скорость реакции зависит от температуры и концентрации реагирующих веществ. (Слайд№2.3) до
Для реакции в газовой фазе скорость r зависит от давления, а для каталитического процесса – и от концентрации катализатора.
Далее слайд 2.4:
Для простой необратимой реакции

Температура оказывает сильное влияние на скорость химической реакции, так как в уравнении Аррениуса температура входит в показатель степени. (2.1)
Зависимость r=f(T) выражается кривой (рис. 2.1). Такая зависимость объясняется тем. Что при низкой температуре скорость процесса мала, поэтому за промежуток времени τ в реакцию вступает лишь незначительная часть исходного реагента А, а поэтому не велик подъем кривой r=f(T). По мере повышения температуры скорость реакции увеличивается в соответствии с уравнением (2.3), что приводит к резкому подъему кривой.

| 
|
| Рис. 2.1. Зависимость скорости химической реакции r от температуры для A→R±Qр | Рис. 2.2. Температурная зависимость константы скорости химической реакции для реакций с E1 (1) и E2 (2): E1 > E2 |
Слайд 2.4 до.
Далее слайд 2.5:
Для сложных необратимых реакций типа:

температура при различных значениях энергии активации реакций (1) и (2) оказывает существенное влияние на селективность процесса по целевому продукту.
Чем выше энергия активации реакции, тем более чувствительна она к изменению температуры. На рисунке 2.2 приведены температурные зависимости для реакций с энергией активации E1 (прямая 1) и E2 (прямая 2). Из рисунка 2.2 следует, при увеличении температуры скорость первой реакции увеличивается в несколько раз интенсивнее, чем второй. Этот вывод чрезвычайно важен при выборе условий проведения параллельных и последовательных реакций. Рассмотрим, например, влияние температуры на дифференциальную селективность для реакции (1) и (2).
В этом случае дифференциальная селективность по целевому продукту R выражается уравнением
 . .
| (2.4) |
Подставив в это уравнение значения rR и rS из уравнений (2.1) и (2.3) находим
 . .
| (2.5) |
Слайд№2.5 до
Все величины, входящие в уравнение (2.5), постоянны, за исключением температуры, поэтому при изменении температуры изменяется также и селективность, и, в зависимости от значения разности E2-E1,влияние температуры может быть либо положительными, либо отрицательным.
Таким образом, если энергия активации целевой реакции превышает энергию активации побочной реакции, то с ростом температуры наблюдается рост дифференциальной селективности, т.е. относительно более быстрое увеличение скорости целевой реакции по сравнению с увеличением скорости побочной реакции и суммарной скорости процесса. Наоборот, если E1<Е2, для увеличения дифференциальной селективности φ нужно понижать, а не повышать температуру.
Далее слайд№2.6:
Концентрация реагирующих веществ также оказывает влияние на скорость простых и сложных реакций: с увеличением концентрации исходных реагентов скорость реакции возрастает. Рассмотрим эту зависимость для различных типов реакций.
Скорость необратимой реакции наиболее простого типа A → R выражается уравнением:
 .
.
После интегрирования этого уравнения в пределах изменения времени от 0 до τ, а концентрации СА от начального значения СА,0 до СА и, принимая, что k не зависит от τ, находим:
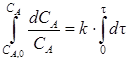 , ,
| (2.6) |
Откуда:
 . .
| (2.7) |
Из уравнения (2.7) следует, что по мере течения реакции, т.е. по мере увеличения τ, концентрация исходного вещества CA снижается по экспоненциальному закону, соответственно уменьшается и скорость реакции (рис. 2.3) слайд№2.6 до. Далее слайд№2.7:

| 
|
| Рис. 2.3. Изменение концентрации компоненов реакции A→R от времени | Рис. 2.4. Изменение концентрации компонентов A, R, и S в реакции A→R; A→S во времени. |
Из рисунка 2.3 также видно, что для того, чтобы довести реакцию до конца, необходимо большое время процесса τ, так как CA асимптотически приближается к нулю.
На практике реакцию не доводят до конца, ее останавливают через некоторый промежуток времени, когда СА>0 и движущая сила процесса достаточно велика; такое время можно назвать оптимальным. В результате того, что реакция проходит не полностью, в конце процесса получают смесь продуктов S и R, которая на последующей стадии разделяется.
Для необратимых параллельных реакций изменение концентрации реагента А и целевого продукта R во времени показано на рисунке 2.4. При этом скорости реакции могут быть выражены уравнениями:
 ,
,
 . .
| (2.8) |
слайд№2.7 до. Далее слайд№2.8:
Наиболее простая схема двух необратимых последовательных реакций может быть представлена в виде:
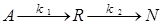 .
.
С течением времени СА снижается, а СR в начале увеличивается, достигает некоторого максимального значения, а затем убывает вследствие его разложения и образования продукта N. При этом концентрация промежуточного продукта R в некоторый момент времени зависит от соотношения скоростей каждой из последовательных реакций.
При этом различают два крайних случая k1>> k2 и k1<<k2.
На рисунке 2.5 и 2.6 показано изменение концентрации А, R и N во времени для каждого их этих случаев. Далее слайд№2.9 1 фрагмент:
Из рисунка 2.5 видно, что если k1>> k2, то при прочих равных условиях, при полном расходе реагента А образуется смесь, содержащая продукты R и N.
Если k1<<k2, то промежуточный продукт R по мере его образования интенсивно расходуется, поэтому с самого начала реакции происходит накопление вещества N. 1 фрагмент.

| 
|
| Рис. 2.5. Изменение концентрации компонентов A, R и N в реакции A→R→N: k1>> k2 | Рис. 2.6. Изменение концентрации компонентов A, R и N в реакции A→R→N: k1<<k2 |
слайд№2.8 до. Далее слайд№2.9:
Скорость рассмотренных последовательных реакций выражается системой уравнений (2.9):
 ,
,
 , ,
| (2.9) |
 .
.
Максимальная концентрация промежуточного вещества CR достигается при условии dCR/d τ =0.
Давление так же оказывает большое влияние на скорость химических процессов, особенно в тех случаях, когда процессы протекают в газовой фазе или же при взаимодействии газов с жидкостями и твёрдыми веществами.
Это объясняется тем, что при повышении давления уменьшается объем газовой фазы и соответственно увеличивается концентрация реагирующих веществ. В некоторых случаях повышение давления дает возможность проводить процесс при температуре, превышающей температуру кипения растворов при атмосферном давлении (что также способствует увеличению скорости процесса).
Катализаторы также оказывают исключительно большое влияние на скорость химических реакций, снижая энергию активации, которая входит в показатель степени уравнения Аррениуса. В результате этого скорость реакции в присутствии катализатора иногда увеличивается в сотни раз. слайд№2.9 до.
Обычно катализатор выбирают с таким расчетом, что бы он обладал селективным действием, т.е. ускоряя процесс получения целевого продукта.
 2020-04-12
2020-04-12 313
313








