Проработки материала
1. По каким признакам классифицируют химические реакции? Перечислите их.
2. От каких факторов зависит скорость химической реакции. Запишите полное кинетическое уравнение.
3. Напишите уравнение основного закона кинетики для простой необратимой и обратимой реакции.
4. Для каких целей используются в химической технологии изобарно-изотермический потенциал Δ G? Приведите примеры.
5. В каких единицах измерения выражается кинетическая константа равновесия? Свои соображения подтвердите примерами.
6. Как влияет температура на скорость обратимой реакции 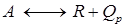 . Для этого случая выведете зависимость r = f(xA, Kp).
. Для этого случая выведете зависимость r = f(xA, Kp).
7. При постоянной температуре протекают две параллельные реакции 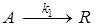 ;
; 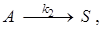 характеризующиеся значениями констант скорости k1 = 10-3 с-1; k 2 = 10-2 с-1. Перед началом реакции СА,0 = 2 кмоль/м3, СR,0= СS,0 = 0. Определите значения скорости химической реакции по исходному реагенту А (rA) и продукту S в момент времени, когда СR = 0,05кмоль/м3, СS = 0,5кмоль/м3.
характеризующиеся значениями констант скорости k1 = 10-3 с-1; k 2 = 10-2 с-1. Перед началом реакции СА,0 = 2 кмоль/м3, СR,0= СS,0 = 0. Определите значения скорости химической реакции по исходному реагенту А (rA) и продукту S в момент времени, когда СR = 0,05кмоль/м3, СS = 0,5кмоль/м3.
8. Каким уравнением описывается зависимость термодинамической константы равновесия от температуры? Приведите его.
9. В гомогенной химической реакции участвуют два реагента А и В. Реакция имеет первый порядок по А и второй по В. Увеличение концентрации какого реагента даст больший эффект увеличения скорости реакции.
10. При температуре 748К константа скорости реакции составляет 3,2·105 ч-1. Определите константы скорости этой реакции при температуре 793К, если ее энергия активации Е = 87,9 кДж/моль. Сравните эти константы скорости.
11. Напишите уравнение Вант-Гоффа и прокомментируйте его.
12. Как влияют температура и давление на равновесие обратимых химических процессов? Приведите примеры.
 2020-04-12
2020-04-12 166
166







