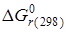 >0 – наиболее вероятное течение реакции справа налево;
>0 – наиболее вероятное течение реакции справа налево;
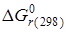 <0 – наиболее вероятно течение реакции слева направо;
<0 – наиболее вероятно течение реакции слева направо;
 = 0 – существует термодинамическое равновесие.
= 0 – существует термодинамическое равновесие.
Представление о том, на сколько глубоко может протекать обратимая химическая реакция, можно получить на основании данных о равновесии этой реакции. В состоянии равновесия, к которому стремятся практически все химические реакции, скорости прямой и обратной реакции становятся одинаковыми, а соотношение концентраций компонентов реакции в рассматриваемой системе остается неизменным. Слайд№2.11 до.
Далее слайд 2.12:
Так, например, условия равновесия реакции 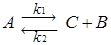 можно записать следующим образом
можно записать следующим образом
- для прямой реакции:
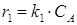 , ,
| (2.15) |
- для обратной реакции:
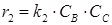 , ,
| (2.16) |
- в состоянии равновесия при r1=r2:
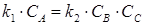 , ,
| (2.17) |
где k1 и k2 – константы скорости прямой и обратной реакции.
Отсюда следует, что:
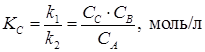 , ,
| (2.18) |
где КС – константа равновесия, выраженная через концентрации реагирующих веществ. слайд№2.12 до.
В зависимости от того, в каких единицах выражаются концентрации реагирующих веществ, константа равновесия принимает различное значение.
Далее слайд 2.13:
При взаимодействии газов константу равновесия обычно выражают через парциальные давления реагирующих газовых компонентов.
Например, для реакции:
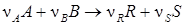
Имеем:
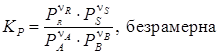 . .
| (2.19) |
 2020-04-12
2020-04-12 132
132








