Метод основан на способности аммиака и ионов аммония образовывать в щелочной среде с реактивом Несслера (K2[HgI4]) окрашенное в желто-оранжевый цвет соединение йодид меркураммония.
При низких концентрациях аммонийного азота (< 3 мг/л) образуется коллоидный раствор, поглощающий свет в интервале длин волн 400-425 нм.
Предел обнаружения 0,05 мг NH4 /л. Диапазон измеряемых масс ионов аммония в пробе 0,005 - 0,150 мг. Проведению анализа мешают амины, хлорамины, ацетон, альдегиды, спирты. В их присутствии аммиак обнаруживают после его предварительной отгонки. Мешающее влияние жесткости воды устраняют введением тартрата калия-натрия (сегнетовой соли). Большие количества железа, сульфидов, мутности удаляют осветлением пробы. Для этого в нее вводят или гидроксид алюминия, или сульфат цинка, доводя pH смеси до 10,5. Выпадающие осадки отфильтровывают.
Проведение испытаний.
Качественное определение с приближенной количественной оценкой.
В пробирку диаметром 13-14 мм наливаем 10 мл исследуемой воды. Прибавляют 0,2-0,3 мл тартрата калия-натрия и 0,2 мл реактива Несслера. Перемешивают. Через 10-15 мин проводят приближенное определение содержания ионовNH4. На основе данных таблицы выбирают объем воды для анализа. Он должен быть таким, чтобы содержание ионов аммония лежало в интервале от 0,01 до 0,05 мг.
Таблица. Окрашивание раствора в зависимости от концентрации ионов аммония
| Окрашивание при рассмотрении сбоку | Концентрация NH/, мг/мл |
| Нет | 0,0001 |
| чрезвычайно слабое желтоватое | 0,0003 |
| слабо желтоватое | 0,0005 |
| светло-желтое | 0,001 |
| Желтое | 0,005 |
| мутноватое, резко-желтое | 0,01 |
| интенсивно бурое, осадок | Более 0,01 |
Концентрация  равна 0,0005.
равна 0,0005.
Количественное определение. Метод сравнения.
Концентрацию ионов аммония в исследуемой воде рассчитывают по результатам измерений светопоглощения исследуемого раствора и стандартного раствора.
В мерную колбу на 50 мл помещают выбранный объем исследуемой воды, доводят до метки дистиллированной водой, добавляют 1 мл 5%-ного раствора тартрата калия-натрия и 1 мл реактива Несслера, перемешивают. Через 10 мин измеряют светопоглощение в кювете с толщиной слоя 5 см при λ= 425 нм относительно раствора сравнения.
В другую мерную колбу на 50 мл помещают 5 мл стандартного раствора (5*0,005 =0,025 мг NH4), доводят до метки безаммиачной дистиллированной водой, далее добавляют все необходимые реактивы и измеряют светопоглощение.
Содержание ионов  во взятом на анализ объеме исследуемой воды рассчитывают по формуле:
во взятом на анализ объеме исследуемой воды рассчитывают по формуле:
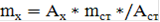
Ах - светопоглощение исследуемого раствора,
Aст- светопоглощение стандартного раствора,
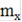 - содержание ионов NН4 во взятом на анализ объеме исследуемой воды, мг,
- содержание ионов NН4 во взятом на анализ объеме исследуемой воды, мг,
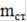 - содержание ионов NH4+ в стандартном растворе, мг.
- содержание ионов NH4+ в стандартном растворе, мг.
В данной лабораторной работе мы получили:
| 1 | 2 | |
| Ст1 | 0,533 | 0,403 |
| Ст2 | 0,457 | 0,39 |
| 1. H2O | 0 | 0 |
| 2. H2O | 0 | 0 |
Концентрацию ионов  мг/л рассчитываю по формуле:
мг/л рассчитываю по формуле:
4+, мг/л = 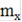 * 1000/V,
* 1000/V,
Где 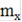 - содержание ионов NH4+ во взятом на анализ объеме исследуемой воды, мг,
- содержание ионов NH4+ во взятом на анализ объеме исследуемой воды, мг,
V - объем анализируемой воды, взятый на анализ, мл.
 +, мг/л = 0
+, мг/л = 0
Вывод: В данной лабораторной работе мы определяли содержание аммонийного азота в анализируемой пробе. Концентрация ионов NH4+ равна 0 мг/л.
Титриметрия
 2020-04-20
2020-04-20 534
534








