Методика:
1. В колбу для титрования отмерить 50мл водопроводной воды. Туда же поместить 5мл аммиачно-буферного раствора и титровать Тритоном Б по кислотному хрому черному до синей окраски.
2. Рассчитайте среднее значение объема Трилона Б 0,05н с (Кп=1,005), пошедшее на титрование, если для расчета берутся результаты титрования, которые отличаются друг от друга на 2 цены деления пипетки.
3. Титрование повторить 6 раз.
4. Результаты записать в лабораторный журнал.
5. Сделать вывод в соответствии с классификацией жесткости.
Классификация жесткости.
5. мягкая вода – до 3ммоль/л
6. средне жесткая вода – 3-6 ммоль/л
7. жесткая вода – 6-10 ммоль/л
8. очень жесткая вода – более 10 ммоль/л
Оформление результатов.
| V1 | V2 | V3 | V4 | V5 | V6 | Vср. |
| 7,96 | 7,55 | 8,0 | 7,95 | 8,0 | 8,0 |
Использовать пипетки объемом 10 мл. Цена их деления 0,1мл.
Ж = 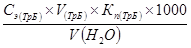
Тест для самоконтроля
1. Цель количественного анализа.
1. Установить количество составных смеси.
2. Определить элементарный состав вещества
3. Выявить одну часть смеси
4. Определить концентрацию компонентов смеси
2. Нейтральная среда
1. 5
2. 7
3. 9
4. 2
3. Кислоты
1. ОН- + кислотный остаток
2. Н+ + кислотный остаток
3. Ме + кислотный остаток
4. Вещества, только неорганической природы
4. Точные пипетки
1. Пастера
2. Градуированная с мёртвым пространством
3. Глазная
4. Мора
5. Цена деления мерной посуды
1. Наименьший объём жидкости
2. Наибольший объём жидкости
3. Объём между двумя цифровыми значениями
4. Объем по мениску
6. Концентрация показывает количество
1. Вещества в (г) в 100 (г) раствора
2. Молей в (г) в 1 литре раствора
3. Эквивалентов в (г) в 1 л раствора
4. Миллитров в 1л раствора
7. Нормальная концентрация показывает количество
1. Вещества в (г) в 100 (г) раствора
2. Молей в (г) в 1 литре раствора
3. Эквивалентов в (г) в 1 л раствора
4. Вещества в (г) в 100 (г) раствора
8. Реакция метода нейтрализации
1. АgС1 + 2 NH3 → [ Аg(NH3)2] С1
2. Н+ + ОН- → НОН
3. Н2SО4 + Zп → Zп SО4 + Н2
4. Ведет к образованию осадка
9. рН = 5,5, значит среда
10. Количество граммов вещества в 100 г раствора
1. Молярная концентрация
2. Нормальная концентрация
3. Мольная доля
4. Массовая доля
11. Численное значение суммы концентраций ионов Н+ и ОН- равно
1. 7
2. 14
3. 10
4. 12
Лабораторно-практическое занятие№23
«Проведение электрометрических методов анализа»
Задание:
1 Изучите материал учебника: Камышников В.С. «Техника лабораторных работ в медицинской практике». 3-е издание переработанное и дополненное М.: «МеЕДпресс-информ», 2013. Стр. 176-178, 182-187
2 Пустовалова Л.М. /Л.М. Пустовалова, И.Е.Никанорова/ - Техника лабораторных работ. Ростов н/Д.: «Феникс», 2004 - 288с.
Материал для самостоятельной работы на практическом занятии
Задание: Внимательно прочитайте предложенный материал. В лабораторной тетради сделайте краткий конспект-схему про плану:
1. Работа с измерительными приборами.
2. Построение калибровочного графика.
3. Устройство и работа КФК - 2
4. В лабораторной тетради заполните таблицу. Вклейте картинки в нужную колонку.
| Рисунок оборудования | Название | Описание и использование оборудования. |
РАБОТА С ИЗМЕРИТЕЛЬНЫМИ ПРИБОРАМИ
В лабораторной практике широко применяют оптические и электрохимические методы анализа, которые связаны с использованием соответствующей аппаратуры. Приборы для исследования химического состава вещества называются оптическими анализаторами состава. К ним относятся поляриметры, рефрактометры, фотометры различных типов, которыми пользуются в химических, биохимических, гигиенических, клинических лабораториях.
 2020-05-12
2020-05-12 96
96








