Пример 1. Напишите электронные конфигурации атомов следующих элементов в основном состоянии: N, Fe, W.
Решение. Энергия атомных орбиталей увеличивается в следующем порядке:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
На каждой s -оболочке (одна орбиталь) может находиться не более двух электронов, на р -оболочке (три орбитали) – не более шести, на d -оболочке (пять орбиталей) – не более 10 и на f -оболочке (семь орбиталей) – не более 14.
В основном состоянии атома электроны занимают орбитали с наименьшей энергией (см. приведенный выше ряд). Число электронов равно заряду ядра (атом в целом нейтрален) и порядковому номеру элемента. Например, в атоме азота – 7 электронов, два из которых находятся на 1 s- орбитали, два – на 2 s- орбитали, а оставшиеся три электрона – на 2 р -орбиталях.
Электронная конфигурация атома азота:
+7N: 1s2 2s2 2p3.
Электронная конфигурация атома железа:
+26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
Электронная конфигурация атома вольфрама:
+74W: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4.
Пример 2. Каков состав ядер изотопов 12С и 13С, 14N и 15N?
Решение. Число протонов в ядре равно порядковому номеру элемента и одинаково для всех изотопов данного элемента. Число нейтронов равно массовому числу (указываемому слева сверху от номера элемента) за вычетом числа протонов. Разные изотопы одного и того же элемента имеют разные числа нейтронов.
Состав указанных ядер: 12С: 6р + 6п;
13С: 6р + 7п;
14N: 7р + 7п;
15N: 7р + 8п.
Пример 3. Описать свойства атома индия по его положению в периодической системе элементов.
Решение. Так как Z =49, заряд ядра атома In и общее количество электронов равны 49. Зная, что свойства атома определяет структура его валентных электронов, начнем с ее построения. Индий находится в 5 периоде III А группы, отсюда его валентные электроны имеют следующую структуру: 5s2 5p1.
Наличие трех электронов на внешнем уровне и большой радиус атома (n =5) предполагают достаточную легкость отдачи электронов (небольшая энергия ионизации) и как следствие - металлические свойства и химическую активность.
Пример 4. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления атомов элементов, их образующих? Какие гидроксиды называются амфотерными (амфолитами)?
Решение. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э—О и О—Н может протекать по двум типам:
| Э─┼─О─┼─Н (I) (II) |
| ЭОН↔Э+ + ОН– |
| ЭОН↔ЭО– +Н+ |
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислотному типу (II) протекает, если 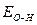 «
«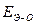 (высокая степень окисления), а по основному типу, если
(высокая степень окисления), а по основному типу, если 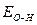 »
» 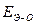 (низкая степень окисления). Если прочности связей О—Н и Э—О близки или равны, диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах (амфолитах):
(низкая степень окисления). Если прочности связей О—Н и Э—О близки или равны, диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах (амфолитах):
Эn+ + nОН– ↔ Э(ОН)n ↔ nН+ +ЭО 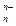 , ,
|
| как основание как кислота |
где Э - элемент, n - его положительная степень окисления. В кислой среде амфолит проявляет основной характер, а в щелочной - средне-кислый:
Ga(OH)3 + 3HCl = GaCl3 + 3H2O
Ga(OH)3 + 3NaOH = Na3GaO3 + 3H2O
 2020-05-25
2020-05-25 147
147








