Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г)+O2(г)↔2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]=a, [О2]=b, [SO3] =с. Cогласно закону действия масс, скорости прямой и обратной реакции до изменения объема
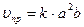
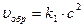 .
.
После уменьшения объема гомогенной системы в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза: [SO2]=3a, [О2]=3b, [SO3]=3c. При новых концентрациях скорости и прямой и обратной реакции:
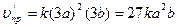
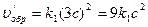 .
.
Отсюда:
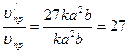 ;
; 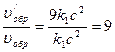
Таким образом, скорость прямой реакции увеличилась в 27 раз, а обратной - только в 9 раз, следовательно, равновесие системы сместилось в сторону образования SО3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70°С, если температурный коэффициент равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
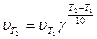 ;
;
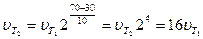
Следовательно, скорость реакции 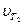 при температуре 70°С больше скорости реакции
при температуре 70°С больше скорости реакции 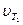 , при температуре 30°С в 16 раз.
, при температуре 30°С в 16 раз.
Пример 3. Константа равновесия гомогенной системы
СО(г)+Н2O(г) ↔ СО2(г) + Н2(г)
при 850°С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [ СО ]исх =3 моль/л, [ Н2О ]исх =2 моль/л.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
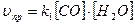 ;
; 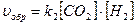 ;
;
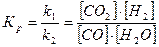 .
.
В условии задачи даны исходные концентрации, тогда как в выражении Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО2]р=x моль/л. Согласно уравнению системы, число молей образовавшегося водорода при этом будет также х моль/л. Столько же моль (х моль/л) СО и Н2О расходуются для образования х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ: [СО2]р = [Н2]р =х моль/л;
[CO]p= (3 - х) моль/л;
[H2O]p = (2 - х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ: 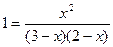 ;
;
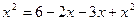 ;
; 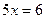 ;
; 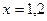 моль/л.
моль/л.
Таким образом, искомые равновесные концентрации:
[СО2]р = 1,2 моль/л
[Н2]р =1,2 моль/л;
[CO]p = 3- 1,2=1,8 моль/л;
[ H2O]p = 2 - 1,2= 0,8 моль/л.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению РСl5(г)↔РС13(г)+С12(г); ΔН = +92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции - разложения PCl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: а) так как реакция разложения РСl5 эндотермическая (ΔН >0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РС13 или С12.
Пример 5. Как изменится скорость реакции 2СО + О2 = 2СО2, если объем газовой смеси уменьшить в два раза?
Решение. Примем обозначения: 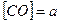 ;
; 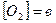 - концентрации до изменения объема. Скорость реакции запишется
- концентрации до изменения объема. Скорость реакции запишется 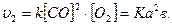 Вследствие уменьшения объема в 2 раза концентрация СО и О2 увеличится во столько же раз:
Вследствие уменьшения объема в 2 раза концентрация СО и О2 увеличится во столько же раз: 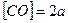 ;
; 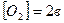 . При новых концентрациях скорость равна
. При новых концентрациях скорость равна 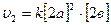 . Рассчитаем, во сколько раз скорость изменилась, для этого запишем:
. Рассчитаем, во сколько раз скорость изменилась, для этого запишем: 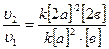
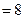 раз.
раз.
Пример 6. Вычислить по правилу Вант-Гоффа, на сколько градусов нужно повысить температуру реакционной смеси, чтобы скорость реакции возросла в 100 раз, если температурный коэффициент реакции равен 3?
Решение. Запишем выражение правила Вант-Гоффа исходя из условия задачи: 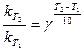 ,
, 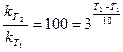 . Прологарифмируем это выражение
. Прологарифмируем это выражение 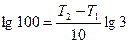 . Отсюда
. Отсюда 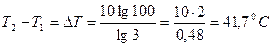 .
.
Пример 7. В какую сторону сместится равновесие данной химической реакции, если увеличить давление в следующей системе: 3Н2 + N2 ↔ 2NH3?
Решение. Задача решается на основании принципа Ле-Шателье. При увеличении давления равновесие сместится вправо, так как этот сдвиг понизит давление вследствие уменьшения общего числа молей в смеси: из 3 молей Н2 и 1 моля N2 образуется 2 моля HN3.
Пример 8. Рассчитать равновесные концентрации водорода и иода при условии, если их начальные концентрации составляли 0,02 моль/л, а равновесная концентрация иодоводорода 0,03 моль/л. Рассчитать константу равновесия.
Решение. Из уравнения реакции Н2 + I2 ↔ 2HI следует, что на образование 0,03 моль/л иодоводорода потребовалось по 0,015 моль/л водорода и иода: следовательно, их равновесные концентрации равны и составляют 0,02-0,015=0,005 моль/л. Константа равновесия:
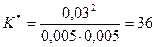 .
.
 2020-05-25
2020-05-25 144
144








