1 Докажите, будет ли взаимодействовать этилен с водой при температуре 298 К и давлении 1,013·105 Па?
2 Рассчитать тепловой эффект реакции Сl2 г+Н2 г = 2НСlг и изменение энтропии этого процесса.
3 Рассчитать количество теплоты, которое выделится при гашении 500 кг извести водой.
4 Сколько теплоты выделится при полном сгорании 100 кг углерода?
5 Рассчитать количество теплоты, которое выделится при сгорании 2 кг этилового спирта (С2Н5ОН).
6 Сколько теплоты выделится при сгорании 120 л ацетилена (С2Н2)?
7-11 Возможно ли самопроизвольное протекание данной реакции при стандартных условиях реакции:
| 7 | 2СdО( т ) + С = 2Сd (т) +СО2(г)? графит |
| 8 | СН4 (г) + СО2(г) = 2СО(г) + 2Н2(г)? |
| 9 | 8Аl (т) + 3Fe3О4( т) = 9Fe (т) + 4Al2О3 (т)? |
| 10 | ZnО (т) + СО(г) = Zn (т) + СО2 (г)? |
| 11 | 2ZnО (т) + С = 2Zn (т) + СО2 (г)? графит |
12–30 Вычислить тепловой эффект реакции при стандартных условиях.
| 12 | 4НСl + О2 = 2Н2О + 2Сl2. |
| 13 | 2NаНСО3 = NаСО3 + Н2О + 2СО2. |
| 14 | СаСО3=СаО+СО2. |
| 15 | Са(ОН)2+ СО2 = СаСО3 + Н2О. |
| 16 | 2СО + SO2 = S + 2CO2. |
| 17 | CH4 + 2O2 = CO2 + 2H2O. |
| 18 | CH4 + CO2 = 2CO+ 2H2. |
| 19 | CO2 + 4H2 = CH4 + 2H2O. |
| 20 | SO3 + H2O = H2SO4. |
| 21 | 3NO2 + H2O = 2 HNO3 + NO. |
| 22 | C2 H5 OH = C2H4 + H2O. |
| 23 | 4NH3 + 5О2 = 4NО + 6Н2О(ж). |
| 24 | 2СdО + С = 2Сd + СО2. |
| 25 | NН3 + НСl(г) = NН4Сl. |
| 26 | ZnS + 3/2О2 = ZnО + SО2. |
| 27 | С2Н5ОН + СН3СООН = СН3СООС2Н5 (ж) + Н2О(ж). |
| 28 | СН3ОН + 3/2О2 = СО2 + 2Н2О(г). |
| 29 | СаС2 + 2Н2О (ж) = Са(ОН)2 (т) + С2Н2. |
| 30 | Fe2О3 + 2Аl = 2Fe + Аl2О3. |
31 Напишите реакцию горения этилового спирта, если в результате образуются СО2 и Н2О. Вычислите тепловой эффект этой реакции, энтальпию и энтропию в стандартных условиях.
32 Напишите реакцию горения этана С2Н6, если в результате образуются СО2 и Н2О. Вычислите тепловой эффект этой реакции, энтальпию и энтропию в стандартных условиях.
33 Напишите термохимическое уравнение реакции взаимодействия газообразных аммиака и хлористого водорода. Сколько теплоты выделится в ходе этой реакции, если было израсходовано 100 л аммиака?
34 При гашении извести СаО выделяется 32,5 кДж теплоты. Напишите термохимическое уравнение реакции и определите энтальпию образования оксида кальция.
35 При стандартных условиях теплота полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?
36 При стандартных условиях теплота сгорания водорода в кислороде равна 286,2 кДж/моль, а теплота сгорания водорода в озоне равна 333,9 кДж/моль. Чему равна теплота образования озона из кислорода при стандартных условиях?
37 Возможна ли реакция 2NO + O2 = 2NO2 при температуре 500 К, если константа равновесия равна 1,05∙10-4, давление газов 101200 Па?
38 Возможна ли реакция N2+3H2↔2NH3 при температуре 300 К, если константа равновесия равна 0,86, давление газов 98900 Па?
39 При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Написать термохимическое уравнение реакции, в результате которой образуются пары воды и диоксида углерода. Вычислите теплоту образования С2Н5ОН.
40 Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему?
41 При сжигании угля происходит основная реакция: С+О2 =СО2 +94,3 ккал. Сколько кубических метров углекислого газа при нормальных условиях и сколько теплоты получится при сжигании 1 млн. т угля?
42 В России на каждого жителя приходится в среднем 0,6 кг вывозимого ежедневно на свалки мусора. Около 10% от массы от этого мусора превращается на свалках в метан и уходит в атмосферу. При сгорании 1 моль метана выделяется 890 кДж тепла. Составить ТХУ и вычислить массу углекислого газа, который может образоваться за сутки при сгорании метана в масштабах России.
43 Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г) + О2(г) = 2NО2(г)? Ответ подтвердить термодинамическими расчетами.
44 При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Написать ТХУ реакции, в результате которой образуются пары воды и диоксид углерода.
45 Возможно ли восстановление хрома из оксида хрома (III); свинца из оксида свинца (II) водородом? Ответ подтвердить термодинамическими расчетами.
46 Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны -285,8 и -241,8 кДж/моль, соответственно. Рассчитайте энтальпию испарения воды при этой температуре.
47 Энтальпии сгорания α -глюкозы, β -фруктозы и сахарозы при 25 оС равны -2802, -2810 и -5644 кДж/моль, соответственно. Рассчитайте теплоту гидролиза сахарозы.
48 При взаимодействии 10 г металлического натрия с водой  H 298=-79,91 кДж, а при взаимодействии 20 г оксида натрия с водой
H 298=-79,91 кДж, а при взаимодействии 20 г оксида натрия с водой  H 298=-76,76 кДж. Вода берется в большом избытке. Рассчитайте теплоту образования оксида натрия
H 298=-76,76 кДж. Вода берется в большом избытке. Рассчитайте теплоту образования оксида натрия  H 0298(Na2O), если
H 0298(Na2O), если  H 0298(H2O (ж)) =-285,8 кДж/моль.
H 0298(H2O (ж)) =-285,8 кДж/моль.
49 Энергия связи в молекуле H2 равна 432,1 кДж/моль, а энергия связи в молекуле N2 равна 945,3 кДж/моль. Какова энтальпия атомизации аммиака, если энтальпия образования аммиака равна -46,2 кДж/моль?
50 При соединении 2,1 г железа с серой выделилось 3,77 кДж. Рассчитать теплоту образованного сульфида железа.
 ТЕМА 5 РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА
ТЕМА 5 РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА
РАСТВОРА
При смешении веществ в твердом, жидком или газообразном состоянии могут происходить либо химические реакции, либо образование смеси веществ, либо оба процесса. Смеси веществ по степени дисперсности (дисперсность - характеристика размеров частиц данного вещества) можно классифицировать следующим образом: грубодисперсные - размер частиц диспергированного вещества составляет 1000 нм и более; коллоидные растворы - размер частиц диспергированного вещества 1-100 нм; истинные растворы - размер частиц диспергированного вещества определяется размером ионов, молекул, ионных пар и различных ассоциатов.
Истинные растворы - гомогенные системы переменного состава, содержащие частицы (атомы, молекулы или ионы) растворенного вещества, частицы растворителя и продукты взаимодействия частиц растворенного вещества с частицами растворителя.
Вещество, присутствующее в растворе в большем количестве, обычно называют растворителем, а другие вещества - растворенными веществами. Если одно из веществ раствора является жидкостью, а другие - твердыми или газообразными веществами, то растворителем принято называть жидкость даже тогда, когда остальные вещества присутствуют в растворе в большем количестве. Растворителем также считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Однако данные определения произвольны и носят условный характер.
В зависимости от агрегатного состояния растворителя различают газообразные (воздух и другие смеси газов), жидкие (гомогенные смеси газов, жидкостей и твердых тел с жидкостями) и твердые (сплавы, стекло) растворы. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол и др.
Состояние раствора определяется тремя основными параметрами: температурой, давлением и концентрацией растворенных веществ. При растворении данного вещества в данном растворителе при постоянных давлении и температуре концентрация растворенного вещества увеличивается не беспредельно. В определенный момент времени вещество перестает растворяться, достигается определенная его концентрация, которая при дальнейшем, даже самом длительном контакте растворяемого вещества и растворителя в условиях интенсивного перемешивания, уже более не изменяется и остается величиной постоянной. Это признак наступления фазового равновесия: растворяемое вещество↔ раствор. Фазовое равновесие «растворяемое вещество↔раствор» по своему характеру является равновесием динамическим: непрерывно какая-то часть вещества переходит в раствор, растворяется, и одновременно такая же часть этого вещества выделяется из раствора:  При этом агрегатное состояние вещества, растворяемого и выделяющегося, является одним и тем же.
При этом агрегатное состояние вещества, растворяемого и выделяющегося, является одним и тем же.
Насыщенный раствор - раствор, находящийся в фазовом равновесии с растворяемым веществом.
Пересыщенный раствор – неустойчивый раствор, в котором содержание растворенного вещества больше, чем в насыщенном растворе этого же вещества, при тех же значениях температуры и давления. Появление в таких растворах кристалла растворенного вещества вызывает одновременное появление в объеме раствора многих кристаллов вещества – массовую кристаллизацию.
Ненасыщенный раствор - раствор, в котором при данных температуре и давлении возможно дальнейшее растворение уже содержащегося в нем вещества. Такие растворы всегда представляют собой однофазную систему.
Количественно состав растворов выражают концентрацией. Концентрация вещества в растворе – величина, измеряемая количеством или массой растворенного вещества в определенном объеме или массе раствора (иногда растворителя). Наиболее употребительны следующие способы выражения концентрации: массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, мольная доля, титр.
Массовая доля (ω) – это отношение массы растворенного вещества к общей массе раствора:
 , (14)
, (14)
где т(Х) – масса растворенного вещества; т(S) – масса растворителя. Массовую долю выражают в долях единицы или в процентах (например, ω = 0,01 или ω = 1%).
Молярная концентрация (СМ) показывает число молей растворенного вещества, содержащееся в 1 л раствора (моль/л):
 , (15)
, (15)
где п(Х) – количество растворенного вещества; М(Х) – молярная масса растворенного вещества; V – объем раствора.
Молярная концентрация эквивалента (нормальная концентрация) (СН) показывает число моль эквивалентов растворенного вещества, содержащееся в 1 л раствора (моль-экв/л):
 , (16)
, (16)
где Э(Х) – эквивалент растворенного вещества.
Моляльная концентрация (Сm) показывает число моль растворенного вещества, содержащееся в 1 кг растворителя (моль/кг):
 , (17)
, (17)
Мольная доля (N(Х)) растворенного вещества – безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
 , (18)
, (18)
где n(S) – количество вещества растворителя.
Титр (Т (Х)) раствора – число граммов растворенного вещества, содержащееся в 1 мл раствора (г/мл):
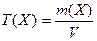 . (19)
. (19)
Очень часто концентрацию насыщенного раствора выражают через коэффициент растворимости (растворимость). Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
 . (20)
. (20)
Растворимость вещества (S) показывает максимальную массу вещества, которая может раствориться в 100 г растворителя при температуре 250С:
 . (21)
. (21)
 2020-05-25
2020-05-25 643
643








