1 Сколько граммов хлорида калия содержится в 750 мл раствора с массовой долей 10%, плотность которого равна 1,063 г/см3?
2 Смешали 250 г 10%-ного и 750 г 15%-ного раствора глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
3 Имеется раствор азотной кислоты с массовой долей 30% (плотность 1,20 г/см3). Какова молярная концентрация этого раствора?
4 Какова массовая доля хлороводорода в соляной кислоте, если в ней на 10 моль воды приходится 1 моль хлороводорода?
5 Для подкормки картофеля применяют раствор хлорида калия с массовой долей 0,4%. Какие массы KCl и Н2О потребуется для приготовления такого раствора объемом 20 л (ρ = 1,0 г/мл)?
6 При 200С и давлении 1,013·105 Па в воде объемом 1 л растворяется HCl объемом 300 л. Рассчитайте массовую долю HCl в этом растворе и моляльность полученного раствора.
7 Через 1 л раствора аммиака с массовой долей, равной 10% (плотность 0,96 г/мл), пропустили 10 л аммиака (н.у.). Вычислите массовую долю аммиака в образовавшемся растворе.
8 Сколько граммов 10%-ного раствора гидроксида натрия потребуется для полной нейтрализации 100 г 0,1М раствора соляной кислоты.
9 Йодная настойка – это 5 % раствор йода в этиловом спирте. Вычислите, сколько мл спирта и граммов йода необходимо для получения 50 г настойки (плотность спирта – 0,8 г/см3).
10 Какой объем 39%-ного раствора серной кислоты (ρ =1,30 г/см3) надо взять для приготовления 1,5 л 0,1 н. раствора?
11 Дана азотная кислота (ρ =1,37 г/см3). Сколько мл кислоты надо взять для приготовления 1 л 6 н. раствора?
12 На консервный завод привезли раствор уксусной кислоты. Опытным путем установлено, что в ее растворе массой 1 кг содержится СН3СООН массой 600 г. Вычислить массовую долю СН3СООН в растворе.
13 Для зарядки аккумулятора требуется серная кислота объемом 5 л с массовой долей кислоты 36% (плотность 1,27 г/см3). Какой объем серной кислоты с массовой долей кислоты 96% (плотность 1,84 г/см3) потребуется для приготовления данного электролита?
14 Семена древесных пород (сосна, ель, ясень) протравливают раствором, массовая доля СН3СООН в котором 0,5%. Определить объем 70% уксусной кислоты (1,07 г/см3) и воды, необходимо для приготовления такого раствора массой 185 кг.
15 Какой объем 0,3 н. раствора соляной кислоты требуется для нейтрализации раствора, содержащего 0,32 г гидроксида натрия в 40 мл раствора?
16 Для декоративного покрытия художественного изделия медью требуется приготовить 3 к г (~3 л) 2%-го раствора сульфата меди. Сколько граммов медного купороса CuSO4·5Н2О нужно взять?
17 Смешали 1 л воды с 250 см3 раствора азотной кислоты (массовая доля 50%, плотность 1,3 г/см3). Какова массовая доля кислоты (%) в полученном таким образом растворе?
18 Вычислите нормальную и молярную концентрации 20%-ного раствора азотной кислоты (плотность 1,12 г/см3). Сколько граммов кислоты содержится в 4 л этого раствора?
19 Для осаждения всего серебра, содержащегося в 100 мл раствора нитрата серебра, потребовалось 50 мл 0,2 н. раствора соляной кислоты. Чему равна нормальная концентрация раствора нитрата серебра?
20 Какую навеску твердого гидроксида натрия необходимо взять для приготовления 50 см3 раствора с концентрацией 0,15 моль/л?
21 На чем основано действие соли при очистке обледеневших тротуаров?
22 Чему равна масса воды, которую необходимо прилить к 200 г раствора гидроксида натрия с массовой долей 30% для приготовления раствора гидроксида натрия с массовой долей 6%?
23 В 1 л воды содержится 0,292 г Mg(HCO3) 2. Определите жесткость воды.
24 В 460 г воды растворили 40 г CuSO4·5Н2О. Вычислите массовую долю кристаллогидрата и безводной соли.
25 Определите жесткость воды, в 100 л которой содержится 20,4 г CaSO4.
26 Сколько граммов соды Na2CO3 надо прибавить к 500 л воды, чтобы устранить ее жесткость, равную 5 мг-экв/л?
27 Анализом установлено, что в 1 л воды содержится 0,2025 г гидрокарбоната кальция Са(НСО3)2. Чему равна жесткость этой воды?
28 В 1 л воды содержится 0,081 г Са(НСО3)2 и 0,272 г CaSO3. Чему равна жесткость этой воды?
29 На практическим туре городской химической олимпиады участникам было поручено приготовить 72%-ный растворы хлорноватистой, хлористой, хлорноватой и хлорной кислот. Победителем был признан участник олимпиады, который приготовил только один раствор. Почему?
30 Какой объем 96%-ной серной кислоты, и какую массу воды нужно взять для приготовления 100 мл 10%-ного раствора серной кислоты (плотность 1,02 г/см3)?
31 Определите массы воды и борной кислоты, необходимые для приготовления 50 г раствора с массовой долей кислоты 0,02. Где применяют данный раствор?
32 Вычислите нормальную, молярную и моляльную концентрации 20%-ного раствора хлорида кальция (плотность 1,178 г/см3).
33 Рассчитайте массы воды и безводного сульфата меди, необходимые для приготовления 100 мл раствора, содержащего 8% соли. Плотность раствора – 1,084 г/мл. Где применяют полученный раствор?
34 Какой объем аммиака, измеренный при н.у., необходимо растворить в 150 мл раствора аммиака, содержащего 10% NН3, и имеющего плотность 0,958 г/мл, для получения раствора, содержащего 15% NН3?
35 Какую массу 32%-го раствора азотной кислоты следует добавить к 500 мл 80%-го раствора той же кислоты с плотностью 1,45 г/мл для получения 65%-го раствора?
36 Какой объем 10% раствора NaОН и какой объем 22% раствора NаОН надо взять для приготовления 1,5 л 14% раствора? Плотности растворов, соответственно, равны: 1,11 г/мл, 1,24 г/мл, 1,15 г/мл.
37 При выпаривании 50 г раствора поваренной соли осталось 10 г сухого остатка. Какой процентной концентрации был раствор?
38 В 16%-ном растворе сульфата магния содержится 0,2 моль соли. Рассчитайте массу раствора.
39 Определите массу воды, которую надо добавить к 20 г 70%-ного раствора уксусной кислоты для получения 3%-ного раствора уксуса.
40 Через 150 г 10 %-ного раствора соляной кислоты пропустили ещё 22,4 л хлороводорода (н.у.). Какова массовая доля получившегося раствора?
41 Для нейтрализации 50 мл серной кислоты потребовалось добавить 20 мл 0,5 н. раствора гидроксида натрия. Определите нормальную и молярную концентрации раствора кислоты.
42 Рассчитайте мольную долю растворенного вещества в 20%-ном растворе фосфорной кислоты.
43 При выпаривании 1 кг 16%-ного раствора гидроксида калия удалено 100 г воды. Определите массовую долю полученного раствора.
44 Смешали 247 г 62%-ного и 145 г 18%-ного растворов серной кислоты. Какова массовая доля полученного раствора?
45 Смешали 1 л воды с 250 см3 раствора азотной кислоты (массовая доля 50%, плотность 1,3 г/см3). Какова массовая доля кислоты (%) в полученном таким образом растворе?
46 Определить, сколько граммов 10%-го раствора оксида серы (VI) в чистой серной кислоте и 60%-го раствора серной кислоты необходимо для приготовления 480 г 90%-го раствора кислоты.
47 Сколько граммов хлорида натрия нужно растворить в 100 г 15,5% раствора NaCl, чтобы его концентрация стала равной 17,5%?
48 Какая масса алюмокалиевых квасцов KA1(SO4)2·12Н2О выкристаллизуется из 320 г насыщенного при 20oС раствора KA1(SO4)2, если испарить 160 г воды из этого раствора при 20oС? (Насыщенный при 20oС раствор содержит 5,5% KA1(SO4)2 по массе).
49 Чему равна масса воды, которую необходимо прилить к 200 г раствора гидроксида натрия с массовой долей 30% для приготовления раствора гидроксида натрия с массовой долей 6%?
50 Растворимость Na2CO3 при температуре 20oС равна 21,8 г в 100 г. воды. Чему равна массовая доля вещества (%) в насыщенном растворе?
 ТЕМА 6 РАСТВОРЫ ЭЛЕКТРОЛИТОВ И НЕЭЛЕКТРОЛИТОВ
ТЕМА 6 РАСТВОРЫ ЭЛЕКТРОЛИТОВ И НЕЭЛЕКТРОЛИТОВ
По способности вещества распадаться или не распадаться в расплаве или растворе на ионы различают, соответственно, электролиты и неэлектролиты. Неэлектролиты - это вещества, которые не распадаются на ионы и вследствие чего их растворы и расплавы не проводят электрический ток. К неэлектролитам относят большую часть органических соединений, например, бензол, глюкозу, крахмал (важнейшие исключения: органические кислоты и органические основания). Электролиты - это вещества, расплавы или растворы, которые проводят электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить растворы кислот, солей и оснований.
В 1887 г. шведский ученый Серванте Аррениус предложил теорию электролитической диссоциации.
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы, т.е. подвергаются электролитической диссоциации.
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником:
CaCl2 «Ca2+ + 2Cl-
KAl(SO4)2 «K+ + Al3+ + 2SO42-
HNO3 «H+ + NO3-
Ba(OH)2 «Ba2+ + 2OH-
Одним из важных понятий теории электролитической диссоциации является понятие о степени диссоциации растворенного вещества. Степенью диссоциации называется отношение числа молекул (n), распавшихся на ионы, к общему числу молекул (N), введенных в раствор:
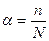 . (22)
. (22)
Очевидно, что степень диссоциации α может изменяться от нуля (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора. Для уксусной кислоты CH3COOH величина α равна 4% (в 0,01М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, т.е. находятся в виде ионов Н+ и СН3СОО -, остальные же 96 молекул недиссоциированы.
Константа диссоциации - вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например, когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kд и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции АхВу ↔ хА + уВ, где комплекс AxBy разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
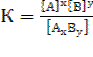 , (23)
, (23)
где [A], [B] и [AxBy] - концентрации A, B и комплекса AxBy соответственно.
Связь между К, α и концентрацией раствора выражается законом разбавления Оствальда:
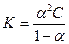 , (24)
, (24)
если α мала, то α в знаменателе по сравнению с единицей можно пренебречь и тогда Кд = α2С. Отсюда:
α = 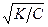 . (25)
. (25)
С точки зрения термодинамики, целесообразно различать идеальные растворы и неидеальные (или реальные). В идеальных растворах компоненты смешиваются как идеальные газы; предполагается, что силы взаимодействия между компонентами отсутствуют, и вещества смешиваются без выделения и поглощения теплоты. Введение понятия «идеальный раствор» вызвано теоретическими соображениями. Чем меньше концентрация реального раствора, тем ближе он к идеальному раствору. Характерным признаком идеальных растворов является строгое подчинение их законам Рауля и Вант-Гоффа.
Если к растворителю с температурой кипения Т0 прибавить нелетучее вещество, то давление пара растворителя понизится. Чтобы раствор имел то же давление пара, что и чистый растворитель, необходимо нагреть раствор выше температуры чистого растворителя. Раулем установлено, что повышение температуры кипения пропорционально концентрации растворенного вещества, т.е.
∆Тк = Ст · Ек, (26)
где ∆Тк – повышение температуры кипения; Ст – моляльная концентрация раствора, моль/кг; Ек – эбулиоскопическая константа растворителя или молярное повышение температуры кипения.
Закон Рауля для случая замерзания раствора записывается аналогично случаю кипения раствора, т. е.
∆Т3 = Ст · К3, (27)
где Кз – криоскопическая константа растворителя или моляльное понижение температуры замерзания.
Процессы кипения и замерзания растворителя или раствора связаны с давлением пара растворителя, которое, согласно закону Рауля, определяется по формуле:
Δр = р0 · N0, (28)
где р0 – давление пара над чистым растворителем; N0 – мольная доля растворителя. Этот закон можно выразить и через мольную долю растворенного вещества.
Относительное понижение давления пара растворителя над раствором равно молярной доле растворенного вещества в растворе:
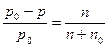 , (29)
, (29)
где 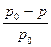 относительное понижение давления пара; n и n0 – соответственно число молей в растворе растворенного вещества и растворителя.
относительное понижение давления пара; n и n0 – соответственно число молей в растворе растворенного вещества и растворителя.
В 1886 году Я.Х. Вант-Гофф применил уравнение Клапейрона-Менделеева к растворенному веществу и получил выражение для расчета осмотического давления растворов следующего вида:
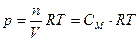 , (30)
, (30)
где См – молярная концентрация растворенного вещества; R - универсальная газовая постоянная; T - термодинамическая температура системы.
Законы Рауля и Вант-Гоффа справедливы для разбавленных растворов неэлектролитов. Если растворенное вещество является электролитом, то число частиц в растворе увеличивается. Поэтому в растворах электролитов понижение давления пара растворителя, понижение температуры замерзания раствора, повышение температуры кипения раствора, осмотическое давление раствора больше, чем в растворе неэлектролита с той же концентрацией.
Для того, чтобы законы Рауля и Вант-Гоффа можно было применять для растворов электролитов, Вант-Гофф ввел в них поправочный множитель i, называемый изотоническим коэффициентом, который как правило, больше единицы. В этом случае законы записывают в следующем виде:
∆Тк = i∙С∙Ек, (31)
∆Т3 = i∙ С∙К3, (32)
росм. = i∙С∙R∙Т, (33)
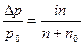 . (34)
. (34)
Теория электролитической диссоциации Аррениуса дала возможность объяснить не только причины отклонения растворов электролитов от законов Вант-Гоффа и Рауля, но и объяснить многие особенности химических свойств электролитов (реакция гидролиза, буферные растворы, значение концентрации ионов водорода и др.). Однако она имела и ряд недостатков, главный из которых - это игнорирование взаимодействия частиц растворенного вещества между собой, а также с молекулами растворителя.
В 1923 г. Дебай и Гюккель создали теорию сильных электролитов, согласно которой в растворах сильных электролитов действуют силы притяжения между разноименными ионами и силы отталкивания между одноименными. Учет этого взаимодействия вложен в понятие активности «а». С понятием «активности» связано и другое понятие – коэффициент активности «ƒ», который характеризует степень отклонения свойств реальных растворов от свойств идеальных растворов. Численно коэффициент активности равен:
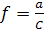 . Для очень разбавленных растворов, где незначительны силы взаимодействия ионов из-за их отдаленности друг от друга, можно принять ƒ=1, и тогда а=С.
. Для очень разбавленных растворов, где незначительны силы взаимодействия ионов из-за их отдаленности друг от друга, можно принять ƒ=1, и тогда а=С.
Таким образом, коэффициент активности показывает, на сколько поведение ионов в растворе электролита при данной концентрации отклоняется от их поведения при бесконечном разведении раствора.
Следует отметить, что коэффициент активности зависит не только от концентрации данного электролита, но и от концентрации других ионов, находящихся в этом растворе, и его величина понижается с возрастанием ионной силы раствора (I). Ионная сила является мерой электростатического взаимодействия между всеми ионами в растворе и вычисляется по формуле:
I = ½ (С1Z12 + C2Z22 +... + CiZi2), (35)
где С1,С2 и Сi – молярные концентрации отдельных ионов в растворе, Z1, Z2, Zi –заряды ионов.
Зависимость коэффициента активности от ионной силы раствора выражается приближенной формулой Дебая-Гюккеля:
lgƒ = -0,5 Z2√I. (36)
В более концентрированных растворах (> 0,1 н.) между заряженными ионами возникает взаимодействие не только электростатического, но и химического порядка.
Электропроводность растворов электролитов характеризуют эквивалентной и удельной электропроводностью.
Эквивалентная электропроводимость λV растворов электролитоврассчитывается по формуле:
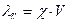 , (37)
, (37)
где V – разведение, объем раствора в см3, содержащего 1 эквивалент растворенного вещества; χ – удельная электропроводность раствора. Данная зависимость может быть выражена и через концентрацию:
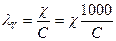 . (38)
. (38)
Предельная эквивалентная электропроводимость раствора может быть представлена суммой предельных электрических проводимостей, или предельных подвижностей ионов:

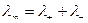 , (39)
, (39)
где λ+ и λ- - предельная эквивалентная электрическая проводимость, или предельная подвижность соответственно катиона и аниона. Данное выражение является законом независимого движения ионов, установленном в 1879 г. Ф.Кольраушем.
Степень электролитической диссоциации сильных и слабых электролитов зависит от электрической проводимости:
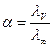 . (40)
. (40)
Зная константу, можно рассчитать концентрации ионов водорода и гидроксид-ионов:
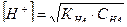 , (41)
, (41)
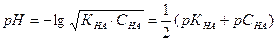 , (42)
, (42)
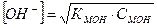 , (43)
, (43)
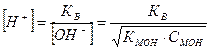 (44)
(44)
где рК=-lgК и рС=-lgС; КНА и КМОН – константа диссоциации кислоты и основания соответственно, С – концентрация.
Гидролиз - это реакция ионного обмена между ионами соли и воды. Различают несколько случаев гидролиза: по катиону, по аниону, по катиону и аниону, необратимый гидролиз.
1. Гидролизу по аниону подвергаются соли, образованные сильным основанием и слабой кислотой.
КОН ← КСN → НСN
КСN + Н2О ↔ КОН + НСN,
СN- + Н2О ↔ НСN + ОН-.
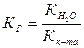 , (45)
, (45)
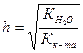 . (46)
. (46)
2. Гидролизу по катиону подвергаются соли, образованные сильной кислотой и слабым основанием.
NН4ОН ← NН4CI → НСI
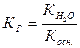 , (47)
, (47)
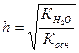 . (48)
. (48)
3. Гидролизу по катиону и аниону подвергаются соли, образованные слабым основанием и слабой кислотой.
NH4ОН ← НN4(CH3COO) → CH3COOH
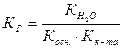 , (49)
, (49)
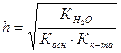 . (50)
. (50)
4. Необратимый гидролиз. В таблице «Растворимость кислот, оснований и солей в воде» вы найдете примечание: «в водной среде разлагаются» - это значит, что такие соли подвергаются необратимому гидролизу. Например, сульфид алюминия А12S3 в воде подвергается необратимому гидролизу, так как появляющиеся при гидролизе по катиону ионы Н+ связываются образующимися при гидролизе по аниону ионами ОН-. Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
А12S3 + 6Н2О = 2Аl(ОН)3↓ + ЗН2S↑.
Поэтому сульфид алюминия А12S3 нельзя получить реакцией обмена между водными растворами двух солей, например хлорида алюминия АlСl3 и сульфида натрия Nа2S.
5. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу: KOH ← KCI → HCI
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Пример 1. Определите концентрации всех частиц в водном растворе плавиковой кислоты С (НF)=0,01 моль/л. Степень электролитической диссоциации НF равна 25%.
Решение. Запишем уравнение электролитической диссоциации:
HF ↔ H+ + F-.
От исходного количества HF - 0,01 моль, содержащегося в 1 л раствора, подверглось диссоциации 25%, или n (HF) = 0,01 моль·0,25 = 2,5·10-3 моль. Концентрация недиссоциированных молекул HF составит:
[HF] = 0,01 - 0,0025 = 0,0075 моль/л = 7,5·10-3 моль.
Так как каждая молекула HF дает при диссоциации один катион Н+ и один анион F-, их концентрации будут равны соответственно:
[H+] = 2,5·10-3 моль/л; [F-] = 2,5·10-3 моль/л.
Пример 2. Чему равна степень электролитической диссоциации СН3СООН в водном растворе с концентрацией кислоты 0,01 моль/л? К =1,86∙10-5.
Решение. Запишем уравнение диссоциации уксусной кислоты СН3СООН ↔ Н+ + СН3СОО - и константу диссоциации:
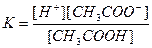 .
.
Определяем концентрации частиц в растворе:
[Н+] = [СН3СОО-] = α · с;
[СН3СООН] = (1 – α) · с
и подставляем в выражении для константы диссоциации СН3СООН. Выражение для константы диссоциации примет вид:
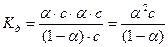 ,
,
учитывая то, что электролит слабый, т.е. α<< 1 и выражение для Кд упростится и запишется:
К = α2 · с.
Подставляя данные в формулу, получим
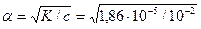 = 4,5·10-2, или 4,5%.
= 4,5·10-2, или 4,5%.
Пример 3. Вычислить рН водного раствора, содержащего 0,001 моль/л НСl.
Решение. Соляная кислота – сильный электролит, α =1, следовательно, концентрация ионов водорода равна исходной молярной концентрации:
HCl ↔ H+ + Cl- ;
рН = - lg[H+] = - lg 0,001 = -(-3) = 3
Пример 4. Рассчитайте концентрацию ионов Н+ в растворе, рН которого равен 2,7.
Решение. рН = -lg[H+]; [H+] = 10- рН = 10-2,7 = 0,002 моль/л.
Пример 5. Найти концентрацию ионов Са2+ в растворе при рН = 13.
Решение. В щелочном растворе возможно осаждение ионов в виде гидроксида кальция Са(ОН)2. Произведение растворимости Са(ОН) 2=5,5·10-6, рОН = 14 - 13 = 1; следовательно [OH-] = 10-1 моль/л.
Определяем концентрацию ионов Са2+ следующим образом:
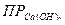 = 5,5·10-6 = [Ca+2]·[OH-]2;
= 5,5·10-6 = [Ca+2]·[OH-]2;
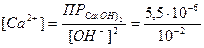 = 5,5·10-4 моль/л.
= 5,5·10-4 моль/л.
Пример 6. Определите рН и степень гидролиза в растворе, содержащем 0,1 моль/л СН3СООNa.
Решение. Запишем уравнение гидролиза ацетата натрия:
СН3СООNa + Н2О = СН3СООН + NаОН
или в сокращенной форме:
СН3СОО- + Н2О ↔ СН3СООН + ОН-
Если гидролизу подверглось Х моль ацетат-ионов, то по уравнению гидролиза [СН3СООН] = [ОН-] = Х, [СН3СОО-] = С – Х, где С – исходная концентрация соли.
Подставляем значение концентрации в выражение константы гидролиза: 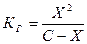 .
.
Так как гидролизу подвергается небольшая часть соли, то С – Х ≈ С, тогда можно записать, что 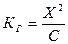 . С другой стороны известно, что
. С другой стороны известно, что 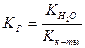 . Подставляя значения, получим:
. Подставляя значения, получим:
[OH-] = X = 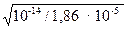 = 7,4 ·10-6 моль/л;
= 7,4 ·10-6 моль/л;
рОН = -lg[OH-] = -lg7,4 ·10-6 = 5,1; отсюда находим рН = 14 – 5,1 = 8,9.
Определяем степень гидролиза [OH-]=С·h или h = 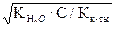 , подставляя данные, получим: h = 7,4 ·10-6 / 0,1 = 7,4·10-5, или h = 7,4 · 10-3 %.
, подставляя данные, получим: h = 7,4 ·10-6 / 0,1 = 7,4·10-5, или h = 7,4 · 10-3 %.
Пример 7. При 180С удельная электропроводимость 5%-ного раствора Mg(NO3)2 равна 4,4·10-2 Ом·см-1. Плотность раствора равна 1,04 г/мл. Вычислить кажущуюся степень диссоциации Mg(NO3)2 в указанном растворе.
Решение. Рассчитаем нормальность 5%-ного раствора:
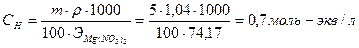
По формуле λV = 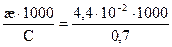 = 62,6 Ом-1 · см-1.
= 62,6 Ом-1 · см-1.
По формуле λ∞ = 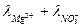 находим λ∞.
находим λ∞.
Подвижность ионов находим в справочнике:
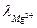 = 53,06;
= 53,06; 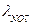 = 62,6, тогда λ∞ =53,06+62,6=115,66 Ом-1·см-1.
= 62,6, тогда λ∞ =53,06+62,6=115,66 Ом-1·см-1.
Рассчитываем α по формуле:
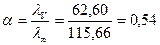 или 54 %.
или 54 %.
Пример 8. Водный раствор, содержащий нелетучее вещество, замерзает при 271,5 К. Определить температуру кипения раствора и давление пара растворителя при 298 К. Криоскопическая константа воды 1,86; эбулиоскопическая константа воды 0,52; давление паров воды при 298 К равно 3167,2 Па.
Решение. Определим понижение температуры замерзания раствора:
ΔТ3 = Т1 - Т2;
ΔТ3 = 273 К - 271,5 К = 1,5 К.
По понижению температуры замерзания, зная Е3, находим моляльность раствора:
ΔТ3 = Ст · К3; Ст = 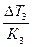 =
= 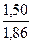 = 0,81 моль/кг.
= 0,81 моль/кг.
По уравнению ΔТк = Ст · Ек, найдем повышение температуры кипения данного раствора: ΔТ = 0,52 ·0,81 = 0,419 К.
Находим температуру кипения раствора: Т = Т1 + ΔТк;
Т = 373 К + 0,419 К = 373,419 К.
Изменение давления пара растворителя определяется по закону Рауля: Δ р=р0·N0. Заменив N0 отношением 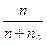 , получим уравнение для расчета давления: Δ
, получим уравнение для расчета давления: Δ 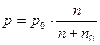 .
.
Мольную долю растворителя п0 рассчитываем по формуле: 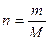
n0 = 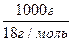 = 55,56 моль.
= 55,56 моль.
Мольная доля растворенного вещества п равна 0,81 моль.
Следовательно, Δр = 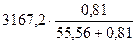 = 45,51 Па. Тогда давление пара будет равно р=р0 -Δр= 3167,2 - 45,51=3121,69 Па.
= 45,51 Па. Тогда давление пара будет равно р=р0 -Δр= 3167,2 - 45,51=3121,69 Па.
Пример 9. Определить осмотическое давление раствора глицерина массовой долей 10% при 150С. Плотность раствора равна 1,023 г/мл.
Решение. Определим молярную концентрацию раствора по формуле:
С = 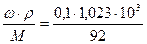 = 1,112 моль/л,
= 1,112 моль/л,
где 92 г/моль – молярная масса глицерина.
Рассчитаем осмотическое давление раствора по формуле росм. = СМRT:
росм. =1,112·8,314·103·288=26,6·105 Па.
Пример 10. Вычислить ионную силу раствора, содержащего в 1 л 0,005 моль Сu(NO3)2 и 0,001 моль Al2(SO4)3.
Решение. Ионная сила раствора вычисляется по формуле:
I = ½(C1Z12 + C2Z22 +... + CiZi2),
где С1, С2 и Сi – молярные концентрации ионов, Z1, Z2 и Zi – заряды ионов. Подставляем значения в формулу, получаем:
I = ½ (0,005·22+0,005·12+2·0,001·32+3·0,001·22)=0,03.
Пример 11. Вычислить коэффициент активности и активность ионов в 0,005 М раствора хлорида цинка.
Решение. Находим ионную силу раствора:
I = ½(0,005·4+2·0,005·1)=0,015.
По формуле lgƒ = -0,5 Z 2 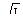 вычисляем коэффициент активности данных ионов. lg
вычисляем коэффициент активности данных ионов. lg 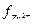 = 0,5 ·22
= 0,5 ·22 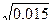 = 0,57
= 0,57
lg 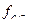 = - 0,5 · 12 · √0,015 = 0,87.
= - 0,5 · 12 · √0,015 = 0,87.
Зная, что активность иона равна произведению его молярной концентрации на коэффициент активности, находим:
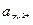 = С·
= С· 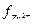 = 0,005·0,57= 2,8·10-3 моль-ионов/л;
= 0,005·0,57= 2,8·10-3 моль-ионов/л;
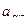 = 2·С·
= 2·С· 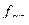 = 2·0,005 ·0,87= 8,7·10-3 моль-ионов/л.
= 2·0,005 ·0,87= 8,7·10-3 моль-ионов/л.
 2020-05-25
2020-05-25 1061
1061








