Пример 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение. Массу выделившегося на катоде веществарассчитываем согласно закону Фарадея: 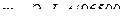 . Эквивалентная масса меди в CuSO4 равна 63,54: 2 = 31,77 г/моль. Подставив в формулу значения Э = 31,77; I = 4 А; t = 60·60 = 3600 с, получим:
. Эквивалентная масса меди в CuSO4 равна 63,54: 2 = 31,77 г/моль. Подставив в формулу значения Э = 31,77; I = 4 А; t = 60·60 = 3600 с, получим:
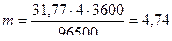 г.
г.
Пример 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Из закона Фарадея: 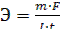 , где
, где 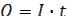 .
.
Тогда 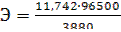 = 29,35.
= 29,35.
Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Согласно закону Фарадея:
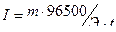 .
.
Так как объем водорода известен, то отношение 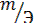 заменим отношением
заменим отношением 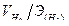 , где
, где 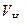 — объем водорода, л;
— объем водорода, л; 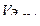 —эквивалентный объем водорода, л.
—эквивалентный объем водорода, л.
Тогда 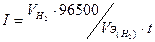 .
.
Эквивалентный объем водорода при нормальных условиях равен половине молярного объема 22,4: 2 = 11,2 л. Подставив в приведенную формулу значения 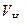 =1,4 л,
=1,4 л, 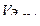 =11,2 л, t = 6025 с (1 ч 40 мин 25 с = 6025 с), находим
=11,2 л, t = 6025 с (1 ч 40 мин 25 с = 6025 с), находим 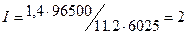 A.
A.
Пример 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора К2SО4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение. Эквивалентный объем кислорода (н.у.) 22,4: 4 = 5,6 л. Следовательно, 11,2 л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11· 2=112,22 г (56,11 г/моль - молярная и эквивалентная масса КОН).
Пример 5. Ток, проходя через раствор кислоты, выделяет за 6 минут 120 см3 водорода, измеренных при 170 С под давлением 98910 Н/ м2. Вычислить силу тока.
Решение. Вычислим массу выделившегося водорода по уравнению:
рV = 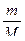 ·RT;
·RT; 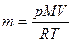 ; T = 170 С+273=290 К;
; T = 170 С+273=290 К;
m = 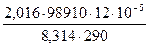 = 0,009924 г.
= 0,009924 г.
Находим силу тока по объединенному выражению законов Фарадея:
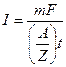 =
= 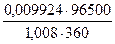 = 2,638 А.
= 2,638 А.
Пример 6. При рафинировании меди ток 50 А выделяет за 4 ч 224 г меди. Рассчитать выход по току.
Решение. Вычислим теоретическое количество меди, которое должно выделиться за 4 ч по закону Фарадея:
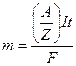 ;
; 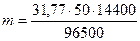 = 237,1 г.
= 237,1 г.
Находим выход по току:
η = 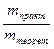 · 100%, η =
· 100%, η = 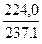 · 100 % = 94,5%.
· 100 % = 94,5%.
Пример 7. При электролизе раствора хлорида натрия было получено 400 см3 раствора, содержащего 18,00 г NaOH. За тоже время в кулонометре выделилось 20,20 г меди из раствора сульфата меди. Вычислить выход по току.
Решение. Учитывая то, что массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональны их химическим эквивалентам: 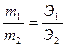 , (Э =
, (Э = 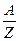 ), можно вычислить теоретическое количество полученной щелочи:
), можно вычислить теоретическое количество полученной щелочи:
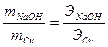 , отсюда
, отсюда 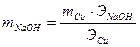 .
.
Вычисляем выход по току: η = 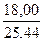 · 100% = 70,76 %.
· 100% = 70,76 %.
Пример 8. Стандартный электродный потенциал никеля больше, чем кобальта. Изменится ли соотношение, если изменить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциал кобальта – в растворе с концентрацией 0,1 моль/л?
Решение. Электродный потенциал металла (φ) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
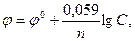
где φ0 – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; C – концентрация (при точных вычислениях - активность) гидратированных ионов металла в растворе, моль/л.
Стандартные электродные потенциалы для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалы этих металлов при данных условиях концентрации:
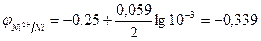 В;
В;
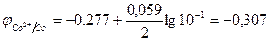 В.
В.
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 9. Магниевую пластину опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (моль/л).
Решение. Задача решается на основании уравнения Нернста:
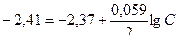 ;
;
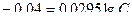 ;
;
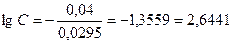 ;
;
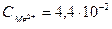 моль/л.
моль/л.
Пример 10. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение.
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Одна вертикальная черта обозначает поверхность раздела между металлом и раствором, а две вертикальные черты - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg0 - 2е = Mg2+
Цинк, потенциал которого равен -0,763 В, - катод, т. е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2e = Zn0.
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов.
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС = 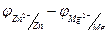 = -0,763- (-2,37) = 1,607 В.
= -0,763- (-2,37) = 1,607 В.
Пример 11. Вычислить при 298 К ЭДС гальванического элемента
(-)Tl | TlNO3 || CuSO4 | Cu(+)
0,2 М 0,1 М
Кажущаяся степень ионизации CuSO4 равна 40%, а TlNO3 – 80%.
Решение. Стандартные электродные потенциалы меди и таллия равны:
φ 0Cu2+/Cu = +0,337 В; φ 0Тl+/Tl = - 0,335 В.
φ = 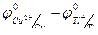 +
+ 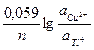 ,
,
подставляя числовые значения, получаем:
φ =0,337-(-0,335) + 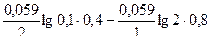 = 0,681 В.
= 0,681 В.
Пример 12. Как должен быть составлен гальванический элемент, чтобы в нем протекала следующая химическая реакция:
2Ag+Hg2Cl2↔2AgCl+2Hg?
ЭДС такой цепи равнялась бы разности стандартных потенциалов?
Решение. Так как серебро окисляется, то хлорсеребряный электрод расположен слева, а каломельный справа:
(-)Аg| АgCl || Hg2Cl| Hg(+)
α =1 α =1
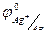 = + 0,222 В,
= + 0,222 В, 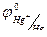 =+0,268 В.
=+0,268 В.
φ = 0,268-0,222 = 0,046 В.
 2020-05-25
2020-05-25 914
914








