1 Понижение точки замерзания 0,01 М уксусной кислоты равно 0,019 К. Рассчитайте степень диссоциации уксусной кислоты.
2 Чему равна ионная сила для 0,01 н. водного раствора СаСl2?
3 Степень электролитической диссоциации α(НNO2)=20% в растворе, содержащем 0,01 моль/л кислоты. Рассчитайте концентрации всех образующихся частиц.
4 Рассчитайте константу диссоциации NH4OH, если в растворе с концентрацией 0,2 моль/л степень его диссоциации равна 0,95%.
5 Вычислите концентрацию ионов ОН--, если концентрации ионов Н+ (моль/л) равны: 1) 10-7; 2) 5·10-9.
6 Вычислите рН растворов, в которых концентрации ионов водорода (моль/л) равны: 1) 3,2·10-5; 2) 4,9·10-12.
7 Вычислить рН раствора КОН (α (КОН)=1%). Плотность раствора примите равной 1,0 г/мл.
8 Когда химики растворяют в воде бесцветные кристаллы дихлорида олова, то обязательно добавляют соляную кислоту, а в склянку с готовым раствором бросают несколько гранул металлического олова. Зачем это делают?
9 Вычислить рН раствора, содержащего 0,1 моль/л NH4OH.
10 Римские художники времен античности умели получать превосходную краску действием уксусной кислоты на металлическую медь. В результате получалась сине-зеленая краска «ярь-медянка» состава CuO∙2Cu(CH3COO)2. Какие реакции лежат в основе получения этой краски?
11 Вычислить рН раствора, содержащего 0,1 моль/л НСl.
12 Запишите уравнение реакций гидролиза и укажите характер среды для следующих солей: Fe(NO3)3; K3PO4; СuCl2.
13 В одном растворе содержится 0,5 моль МgSO4, 0,1 моль АlCl3 и 0,2 моль (NH4)2SO4 на 1000 г воды. Рассчитайте ионную силу раствора.
14 Садоводы и огородники борются с грибковыми заболеваниями растений с помощью медного купороса, готовят его 0,5%-ный раствор для опрыскивания грядок. Медный купорос хорошо растворим в воде, но раствор указанной концентрации всегда оказывается мутным. Почему?
15 Вычислить константу диссоциации NH4OH, если при данной температуре 0,1 н. раствор имеет рН =11,27. Ионное произведение воды при этой температуре 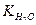 = 0,7·10-14.
= 0,7·10-14.
16 Криоскопическая постоянная камфары равна 40, а температура плавления 452 К. Определите температуру плавления смеси, содержащей 2% мочевины в камфаре.
17 Французские виноградари широко использовали «бургундскую смесь» - ядохимикат для защиты плантаций от грибковых болезней растений. Эта смесь получила название от имени французской провинции, а ее приготовление основано на реакции гидролиза. Что это за смесь?
18 Вычислить осмотическое давление раствора при 22˚С, в 1,2 л которого содержится 20,5 мг сахара (С12Н22О11).
19 Вычислить температуру кипения и температуру замерзания раствора, содержащего 100 г сахара в 750 г воды. Ек = 0,52; Кз = 1,86.
20 Рассчитайте давление пара водного раствора глицерина массовой долей 3%, взятого при 250С. Давление пара воды при этой температуре равно 31,67 кПа.
21 В 1547 г. Иван грозный поручил немцу Шлитте ехать посланником в Немецкую землю и вывезти оттуда «мастера для варения квасцов». Но это сделать не удалось: Шлитте был схвачен и заключен в тюрьму во владениях Ливонского ордена. Алюмокаливевые квасцы (додекагидрат сульфата алюминия-калия KAl(SO4)2∙12H2O) широко использовались в медицине и для производства серной кислоты, которую в то время называли «кислым спиртом». Вот как М.В. Ломоносов описывал квасцы: «Квасцы от своего кислого воздуха на российском языке и имя себе весьма правильное имеют, ибо кроме того, что оне очень кислы, еще и через перегонку из реторты дают весьма кислый спирт, который с купоросной кислотой одной натуры». Что происходит с квасцами при растворении в воде и при нагревании?
22 При 180 С удельная электропроводность 5% раствора Мg(NO3)2 равна 4,38·10-2 Ом-1∙см-1. Плотность раствора равна 1,04 г/мл. Вычислить кажущуюся степень ионизации Мg(NO3)2 в указанном растворе.
23 Определите объем углекислого газа (н.у.), который может быть получен при смешении 15 мл 7 %-ного раствора карбоната натрия (ρ = 1,07 г/мл) и 20 мл 16 %-ного раствора азотной кислоты (ρ = 1,09 г/мл).
24 Напишите выражения для констант диссоциации следующих кислот: муравьиной, сероводородной, хлорноватистой, угольной, уксусной. Можно написать такие выражения для азотной, хлорной, хлороводородной кислот? Дать понятие «степень диссоциации».
25 Около 35 лет назад кислотность дождевой воды в мире составляла в среднем 5,6 единиц рН. С тех пор концентрация ионов водорода увеличилась в 40 раз. Рассчитайте среднее значение рН дождевой воды в настоящее время.
26 На основании расчётных данных построить график зависимости степени диссоциации уксусной кислоты от концентрации раствора. (К =1,8∙10-5). Сделать вывод.
27 Раствор, содержащий 0,87 моль сахара (С12Н22О11) в 1 л при 291 К изотичен с раствором NаCl, содержащего 0,5 моль NaCl в 1 л раствора. Определить кажущуюся степень ионизации NaCl и коэффициент Вант-Гоффа для раствора NaCl.
28 Вычислить степень диссоциации и рН 1,6·10-4 М СН 3СООН при 298 К, константа диссоциации кислотыравна 1,75·10-5.
29 При какой температуре замерзает раствор, содержащий 200 г NaCl в 1000 г воды. Степень диссоциации NaCl принять равной 0,67.
30 Чтобы определить силу кислоты, достаточно заглянуть в справочник и найти там значение константы диссоциации; чем оно больше, тем сильнее кислота. Но существует один простой способ приближенной оценки силы кислородсодержащих кислот, таких как H3PO4, B(OH)3, HNO2, HClO3, HMnO4 и т.п., который заключается в применении правила Полинга. Что же это за правило?
31 При действии хлорида аммония на раствор силиката натрия выделяется газ и образуется осадок. Объясните наблюдаемые процессы и составьте уравнение реакции.
32 Территория вокруг некоторого завода, производящего минеральные удобрения и химреактивы, из-за нарушения условий складирования готовой продукции загрязнена следующими веществами: хлоридом калия, нитратом аммония и нитратом алюминия. Какая будет там почва: кислая, щелочная или нейтральная? Составить уравнения реакций гидролиза в молекулярной и ионной формах.
33 Цианид калия – один из самых сильных ядов, и хранят его обязательно «под замком». Но однажды утром лаборант, вынув из сейфа банку с надписью KCN, обнаружил, что крышки нет, характерный слабый запах миндаля исчез, а между тем объем содержимого не уменьшился… Анализ показал, что вещество в банке вовсе не цианид калия. Кто виноват в пропаже?
34 Необычайно эффектный поделочный камень густо-зеленого цвета, минерал малахит – продукт реакции гидролиза. Как происходит этот гидролиз?
35 Почему посуду из алюминиевых сплавов нельзя мыть средствами, содержащими соду?
36 Известный каждой хозяйке порошок для отбеливания при стирке «Персоль» - пероксокарбонат натрия 2Na2CO3∙3H2O2 – в кипящей воде выделяет кислород и обесцвечивает загрязнения. Можно ли считать, что действие персоли основано на реакциях гидролиза?
37 Зачастую перед спаиванием металлических деталей их поверхность очищают от оксидной пленки, обрабатывая «паяльной кислотой» - раствором хлорида цинка. Как же получается, что эта соль действует и применяется как «кислота»?
38 В 1852 г. немецкий химик Фридрих Велер пытался выделить металлический кальций из карбоната кальция (известняка), прокаливая его с древесным углем. Он получил спекшуюся массу сероватого цвета, в которой не обнаружилось никаких признаков металла. С огорчением Велер выбросил массу на свалку во дворе лаборатории. Во время дождя лаборанты заметили, что каменистая масса выделяет неизвестный газ. Что это за газ?
39 Правда ли, что при длительном кипячении раствор хлорида аммония становиться более кислым, а раствор сульфида натрия – более щелочным? Почему это происходит?
40 Осмотическое давление раствора глицерина при 00С равно 133,3 Па. Рассчитайте осмотическое давление этого раствора при 350С.
41 Рассчитайте при какой температуре замерзнет раствор этилового спирта в воде с концентрацией, равной 40%. Криоскопическая постоянная воды 1,86 К∙кг/моль.
42 Водный раствор этилового спирта, содержащий 8,74 г спирта в 1000 г Н2О, замерзает при -0,3540С. Найти молярную массу спирта. Криоскопическая постоянная воды равна 1,86 К∙кг/моль.
43 При 250С давление паров воды равно 3·103 Па. Чему равно давление паров воды над раствором, содержащим 10 г мочевины в 200 г Н2О?
44 При температуре 270С осмотическое давление раствора сахара (С12Н22О11) в воде равно 1,05·105 Па. Рассчитайте осмотическое давление этого раствора при 00С.
45 Давление насыщенного пара Н2О при 400С равно 7376 Па. Вычислите давление пара растворителя над раствором, содержащим 10 г глицерина в 400 г Н2О.
46 Рассчитайте криоскопическую константу воды, зная, что раствор, содержащий 0,524 г сахара (С12Н22О11) в 75 г Н2О замерзает при -0,0380С.
47 Уксусная кислота была единственной, которую знали древние греки. Отсюда и ее название: "оксос" - кислое, кислый вкус. Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов. Установлено, что в 0,01 M растворе уксусной кислоты степень диссоциации α составляет 4,2%. Рассчитайте рН этого раствора.
48 На чем основано применение антифризов в автомобилях?
49 На предприятии не хватило запаса соды для нейтрализации кислотных отходов, и 3,15 кг азотной кислоты было вылито в канализацию, а оттуда попало в пруд емкостью 10000 м3. После этого в пруду погибла вся рыба, даже такая неприхотливая, как плотва. Определите водородный показатель воды, загрязненной азотной кислотой.
50 Самый дешевый щелочной реагент для нейтрализации кислотных промышленных стоков - гашеная известь (гидроксид кальция). Используют как суспензию гидроксида кальция («известковое молоко»), так и прозрачный раствор («известковую воду»). Рассчитайте рН 0,02 М раствора Ca(OH)2.
 ТЕМА 7 ОСНОВЫ ЭЛЕКТРОХИМИИ
ТЕМА 7 ОСНОВЫ ЭЛЕКТРОХИМИИ
Электрохимия - наука, изучающая физико-химические процессы, которые сопровождаются появлением электрического тока или, наоборот, происходят под действием на химические соединения электрического тока.
Электрохимия возникла на рубеже 18-19 веков благодаря работам Л. Гальвани и А. Вольта, результатом которых было создание первого химического источника тока - «вольтова столба». Используя химические источники тока, Г.Деви в начале 19-го века осуществил электролиз многих веществ. Законы электролиза были сформулированы М. Фарадеем в тридцатых годах 19-го века.
Современная теория электрохимии включает два раздела - ионику и электродику. В первом рассматриваются однофазные системы - растворы, расплавы, твердые электролиты как при равновесии, так и в неравновесных условиях. Электродика изучает электрохимические явления на границе двух фаз: термодинамику этих явлений, строение границы раздела фаз и электрохимическую кинетику.
Существует тесная связь электрохимии с коллоидной химией, поскольку проблемы адсорбции на заряженных поверхностях и электрокинетические явления рассматриваются в обоих разделах химии.
Большое практическое значение имеют прикладные аспекты электрохимии. Создано мощное электрохимическое производство, которое включает электролиз, электросинтез, гидроэлектрометаллургию, гальванотехнику. Важную роль играет создание автономных химических источников тока и электрохимических преобразователей информации, разработка эффективных методов борьбы с коррозией металлов и сплавов.
Электрический ток (постоянный) в электролитах всегда сопровождается выделением на электродах химических частей электролита. Это явление было тщательно исследовано М. Фарадеем, который установил на опыте два закона электролиза. Согласно первому закону Фарадея, масса вещества, выделившаяся на каком-либо из электродов, пропорциональна величине заряда, прошедшего через электролит:
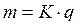 , (51)
, (51)
где К - электрохимический эквивалент, различный для разных веществ. Он равен массе вещества, выделяемой при электролизе зарядом q =1 Кл. Значения электрохимических эквивалентов для некоторых веществ приведены в таблице 6.
Второй закон Фарадея устанавливает связь между электрохимическими эквивалентами и химическими эквивалентами веществ. Согласно второму закону, электрохимический эквивалент пропорционален химическому эквиваленту данного вещества:
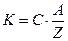 , (52)
, (52)
где 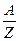 – химический эквивалент вещества (А – атомная масса; Z – валентность); С - коэффициент пропорциональности (имеет одно и тоже значение для всех веществ).
– химический эквивалент вещества (А – атомная масса; Z – валентность); С - коэффициент пропорциональности (имеет одно и тоже значение для всех веществ).
Таблица 6 – Электрохимические эквиваленты некоторых веществ
| Вещество | Атомная масса (А), а.е.м. | Электрохимический эквивалент (К), кг/Кл |
| Серебро Медь Водород Кислород Хлор | 107,90 63,57 1,0 16,00 35,46 | 1,118 · 10-6 3,294 · 10-7 1,045 · 10-8 0,829 · 10-7 3,674 · 10-7 |
Оба закона Фарадея можно выразить одной формулой:
 , (53)
, (53)
где 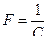 - число Фарадея, равное 96500 Кл.
- число Фарадея, равное 96500 Кл.
На практике, как правило, на электродах выделяется вещества меньше, чем следует из законов Фарадея. Это объясняется протеканием параллельно основной электродной реакции побочных реакций. Для оценки потерь электричества на побочные реакции введено понятие выхода по току (η):
η =  100%, (54)
100%, (54)
где mпракт и mтеор – количество вещества, найденное из опыта и рассчитанное по закону Фарадея соответственно.
Процессы, протекающие на электродах при электролизе растворов, представлены в таблицах 7 и 8.
Таблица 7 - Катодные процессы
| Li K Ca Na Mg AI Li+ K+ Ca2+ Na+ Mg2+ AI3+ | Mn Zn Fe Ni Sn Pb Mn2+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ | H2 2H+ | Cu Hg Ag Pt Au Cu2+ Hg22+ Ag+ Pt2+ Au3+ |
| Восстанавливается вода: 2Н2О + 2ē = Н2↑ + 2ОН-; Мn+ не восстанавливается | Восстанавливаются катионы металла и вода: Мn+ + nē = M0; 2Н2О + 2ē = Н2↑ + 2ОН- | Восстанавливаются катионы металла: Мn+ + nē = M0 | |
|
Усиление окислительных свойств катионов (способности принимать электроны) | |||
Таблица 8 - Анодные процессы
| Кислотный остаток Асm- | Анод | |
| Растворимый (железо, цинк, медь, серебро) | Нерастворимый (графит, золото, платина) | |
| Бескислородный | Окисление металлов анода М0 - nē = Mn+;
| Окисление аниона (кроме F-) Acm- - me = Ac0 |
| Кислородосодержащий | В кислотной и нейтральной средах: 2Н2О - 4ē = O2↑ + 4H+ В щелочной среде: 4OH- - 4ē = O2↑ + 4H+ | |
Чтобы процесс электролиза шел с заметной скоростью, необходимо приложить напряжение, превышающее некоторую минимальную величину, определенную для каждого электролита в данных условиях и называемую напряжением разложения. Причиной возникновения последнего можно назвать сопутствующие электролизу явления, называемые электрической поляризацией.
Величина перенапряжения зависит от плотности поляризующего тока. Соотношение между ними хорошо описывается формулой Тафеля:
η = α + b ln i, (55)
где α и b – константы.
Константа α уравнения Тафеля - величина перенапряжения при плотности тока, равной единице, зависит от природы металла электрода, состояния его поверхности, состава раствора и температуры. Константа b характеризует степень необратимости процесса на электроде: чем больше α, тем больше перенапряжение при данной плотности тока. Константа b для всех металлов равна приблизительно 0,12.
Гальваническим элементом называется устройство, в котором энергия химической окислительно-восстановительной реакции превращается в электрическую. Простейший гальванический элемент представляет собой систему, состоящую из любых двух металлических электродов (проводники I рода), погруженных в растворы электролитов (проводники II рода); обычно металл погружается в раствор, содержащий ионы этого же металла. Растворы отделяются друг от друга пористой перегородкой или электролитическим мостиком. Одним из первых гальванических элементов, предложенным в середине прошлого века русским физиком Якоби и французским ученым Даниэлем, был элемент Якоби-Даниэля.
В результате работы элемента Якоби-Даниэля на цинковом электроде происходит окислительный процесс:
Zn0 - 2e → Zn 2+,
а на медном - восстановительный:
Cu2 + 2e → Cu 0.
Таким образом, в гальваническом элементе окислительный и восстановительный процессы происходят раздельно на электродах, что позволяет превращать химическую энергию в электрический ток, который можно использовать для совершения полезной работы.
Важной характеристикой любого гальванического элемента является его электродвижущая сила (ЭДС), которая выражается алгебраической разностью электродных потенциалов, т.е.
ЭДС = φ1- φ2. (56)
Величина электродного потенциала определяется уравнением Нернста:
φ = φ0+ 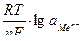 , (57)
, (57)
где φ – электродный потенциал металла; φ0 – стандартный электродный потенциал металла (Т =298 К, р =1,013·105 Па); R - универсальная газовая постоянная; T - температура; n – число отданных или принятых электронов; F - число Фарадея; 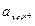 - активность ионов металла.
- активность ионов металла.
Для элемента Якоби-Даниеля ЭДС можно рассчитать по уравнению:
φ = 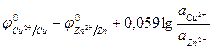 . (58)
. (58)
Для разбавленных растворов активности ионов в уравнениях могут быть заменены концентрациями, так как коэффициент активности для разбавленных растворов можно принять равным единице.
 2020-05-25
2020-05-25 585
585

 nē
nē






