Свойство насыщенного раствора сохранять постоянным произведение активностей (концентраций) ионов в соответствующих степенях называют правилом произведения растворимости.
Следствия из правила произведения растворимости:
I. Для насыщенного раствора всегда соблюдается равенство: величина произведения растворимости равна произведению концентраций ионов (ПКИ), т. е. ПР ВаSO4 = [Ba2+][SO42–].
II. Если произведение концентрацией ионов превышает величину ПР, то осадок образуется: ПР ВаSO4 < [Ba2+][SO42–].
III. Если произведение концентраций ионов меньше величины произведения растворимости, то образование осадка не происходит: ПР ВаSO4 > [Ba2+][SO42–].
Пример 5. Образуется ли осадок хлорида свинца (II), если смешать равные объемы растворов 0,1М Pb(NO3)2 и 0,1М КСl? ПР PbCl2 = 1,6 · 10–5.
Решение:
Pb(NO3)2 + 2КСl = PbCl2 + 2К NO3
После смешивания равных объемов растворов их концентрация уменьшилась в 2 раза:
[Pb2+] = 0,1/2 = 0,05 моль/л; [Cl–] = 0,1/2 = 0,05 моль/л.
Произведение концентраций ионов (ПКИ) равно:
[Pb2+][Cl–]2 = 5 · 10–2 · (5 · 10–2)2 = 1,25 · 10–4.
Поскольку ПКИ (1,25 · 10–4) превышает величину ПР (1,6 · 10–5), то осадок образуется.
Растворение соединения, т. е. переход вещества из твердого состояния в раствор, будет происходить до тех пор, пока произведение концентраций ионов в соответствующих степенях не станет равным произведению растворимости.
Пример 6. Рассчитайте рН осаждения гидроксида магния из 0,01М раствора сульфата магния.
 = 6,0 · 10–10.
= 6,0 · 10–10.
Решение:
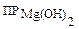 = [Mg2+][OH–]2. Из данного равенства следует:
= [Mg2+][OH–]2. Из данного равенства следует:
[OH–] = 
Содержание ионов магния в растворе определяется концентрацией сульфата магния:
MgSO4 → Mg2+ + SO42–
0,01 моль/л → 0,01 моль/л
Тогда: [OH–] =  2,45 · 10–4 моль/л.
2,45 · 10–4 моль/л.
рОН = –lg[OH–] = –lg 2,45 · 10–4 = 3,61.
рН – 14 – 3,61 = 10,39.
Для растворения осадка необходимо, чтобы произведение концентраций ионов стало меньше величины произведения растворимости. Это достигается снижением концентрации ионов в растворе над осадком. Уменьшение концентрации ионов в растворе может быть осуществлено:
1) сильным разбавлением;
2) связыванием ионов осадка в слабодиссоциирующее соединение;
3) связыванием ионов осадка в комплексное соединение;
4) Окислением или восстановлением ионов.
 2020-06-08
2020-06-08 558
558








