Пример 4. Сравните растворимость СаСО3 в воде и в 0,01М растворе (NH4)2CO3.
ПР СаСО3 = 4,80 · 10–9.
Решение:
1. Растворимость СаСО3 в воде: S1 СаСО3 = 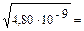 7,0 · 10–5 моль/л.
7,0 · 10–5 моль/л.
2. Растворимость СаСО3 в присутствии электролита карбоната аммония, который имеет одноименный ион с осадком, определяется концентрацией карбонат-ионов в растворе:
(NH4)2CO3 → CO32– + 2NH4+
0,01 моль/л → 0,01 моль/л
S2 = [Ca2+] = 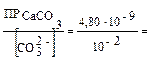 4,8 · 10–7 моль/л.
4,8 · 10–7 моль/л.
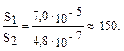
Растворимость малорастворимых электролитов понижается при введении в их раствор сильных электролитов с одноименным ионом.
Одноименный ион оказывает более значительное влияние на растворимость соединения, чем ионная сила раствора.
 2020-06-08
2020-06-08 310
310








