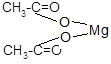| Описание опыта | Наблюдения |
| Опыт 1. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала») В чистую пробирку вводят 2 капли раствора нитрата серебра, прибавляют 2 капли раствора аммиака, 1-2 капли раствора формальдегида. Подогревают содержимое пробирки над пламенем горелки. Химизм процесса: АgNО3 + 3NН4ОН ® [Аg (NН3)2]ОН + NН4NО3 + Н2О НСОН + 2 [Аg (NН3)2]ОН ® НСООН + 2Аg + 3NН3 + Н2О | Раствор прозрачный. Содержимое пробирки буреет и на ее стенках выделяется серебро в виде блестящего зеркального налета |
|
Вывод: Эта реакция является качественной реакцией на альдегиды. | |
| Опыт 2. Окисление альдегидов гидроксидом меди (II) В пробирку помещают 4 капли раствора гидроксида натрия, разбавляют его 4 каплями воды и добавляют 2 капли раствора сульфата меди. Прибавляют 1 каплю раствора формальдегида и взбалтывают содержимое пробирки. Нагревают над пламенем горелки до кипения только верхнюю часть раствора так, чтобы нижняя часть оставалась для контроля холодной. Химизм процесса: СuSО4 + 2NаОН ® Cu(ОН)2 + Nа2SО4 НСОН + 2Cu(ОН)2 ® НСООН + 2CuОН + Н2О 2CuОН ® Сu2О + Н2О | Выпадает осадок голубого цвета В нагретой части пробирки выделяется желтый осадок гидроксида меди (II) CuОН, переходящий в красный оксид меди (I) Сu2О, а иногда на стенках пробирки выделяется даже металлическая медь. |
| Вывод: Эта реакция также является качественной реакцией на альдегиды. | |
|
| |
| Опыт 3. Цветная реакция на ацетон с нитропруссидом натрия В пробирку вносят 1 каплю раствора нитропруссида натрия, 2 капли воды и 1 каплю водного раствора ацетона. Добавляют 1 каплю раствора гидроксида натрия, затем добавляют 1 каплю раствора уксусной кислоты. | смесь окрашивается в красный цвет. смесь принимает вишнево-красный оттенок. |
| Вывод: Эта реакция является качественной на ацетон. | |
| Опыт 4. Получение йодоформа из ацетона Помещают в пробирку 3 капли раствора йода в йодистом калии и 5 капель раствора гидроксида натрия. К бесцветному раствору йодноватистокислого натрия добавляют 1 каплю ацетона. Химизм процесса: I2 + 2NаОН ® NаОI + NаI + Н2О CН3–СО–СН3 + 3NаОI ® CН3–СО–СI3 + 3NаОН CН3–СО–СI3 + NаОН ® CН3–СО–ОNа + СНI3 | Раствор обесцвечивается. Мгновенно без нагревания выпадает желтовато-белый осадок с характерным запахом йодоформа. |
| Вывод: Эта реакция очень чувствительная и используется для открытия ацетона. | |
Лабораторная работа №7 Тема: «Карбоновые кислоты» Исследование свойств карбоновых кислот и их производных Отчет по проделанной работе
| |||||||||||||||||||||||||||||
 2020-06-29
2020-06-29 1342
1342