Метиламин, диметиламин и триметиламин — газообразные вещества, с запахом аммиака, хорошо растворяются в воде. Средние члены алифатического ряда – жидкости со слабым запахом тухлой рыбы.Высшие амины (начиная с С16Н35N — твердые нерастворимые вещества, не имеющие запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества, практически нерастворимые в воде. Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Химические свойства.
. Взаимодействие анилина с соляной кислотой.
С6H5NH2 + HCl → (С6H5NH3)+ Cl- получился хлорид фениламмония
Таким образом, АМИНЫ представляют собой органические основания.
Горение анилина.
4CH3NH2 + 9O2 → 4CO2 + 2N2 + 10 H2O
Галогенирование анилина.
C 6 H 5 NH 2 + 3Br 2 → C 6 H 2 NH 2 Br 3 + 3HBr
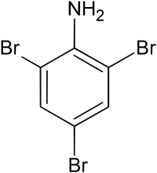 2,4,6-Триброманилин
2,4,6-Триброманилин
Получение аминов
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
Г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности
Восстановление нитросоединений:
R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O
(р. Зинина) гордимся!!
Другие способы:
1). Промышленный
CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br
2). Пропусканием паров спирта и аммиака при 300оС над катализатором.
С  2Н5ОН + NН3 С2Н5-NН2 +Н2О
2Н5ОН + NН3 С2Н5-NН2 +Н2О
Применение.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Аминокислоты
1.Аминокислотами называются азотсодержащие соединения, в молекулах которых содержатся аминогруппа – NH2 и карбоксильная группа – СООН, связанные с углеводородным радикалом
2. Общая формула аминокислот: NH2—R—COOH
3. Номенклатура, аминокислот в основном выражается разным строением углеродной цепи и положением аминогруппы:
4 3 2 1
СН3 – СН2 – СН – СООН 2 – аминобутановая кислота
|
NH2
СН3
3 2 | 1
СН2 – СН – СООН 3- амино- 2- метилпропановая кислота
|
NH2
Кроме международной номенклатуры, употребляются еще названия аминокислот, в которых вместо цифр ставят буквы греческого алфавита: α, β, γ и.т.д.
Например: (записываем на доске)
γ β α
СН3 – СН2 – СН – СООН
|
NH2
α – аминобутановая кислота
γ β α
СН3 – СН – СН2 – СООН
|
NH2
β – аминобутановая кислота
4.Физические свойства: бесцветные кристаллические вещества с температурами плавления 150 - 250oС, хорошо растворимы в воде (лучше, чем в органических растворителях), многие - сладкие
Химические свойства
1) Реакции с растворами кислот:
NH2CH2COOH + HCl 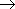 (NH3CH2COOH)Cl
(NH3CH2COOH)Cl
2) Реакции с растворами щелочей:
NH2CH2COOH + NaOH 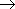 NH2CH2COONa + H2O (аминоацетат натрия)
NH2CH2COONa + H2O (аминоацетат натрия)
Аминокислоты - амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
3) Реакция горения аминоуксусной кислоты
4NH2CH2COOH + 13O2 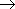 8CO2 + 10H2O + 2N2
8CO2 + 10H2O + 2N2
4). Поликонденсация → образуются полипептиды (белки):
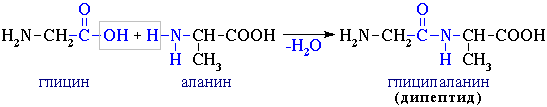
При взаимодействии двух α-аминокислот образуется дипептид.
6.Получение аминокислот:
а)Из карбоновых кислот:
Стадия
CH3—CH2—COOH + Cl2 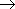 CH3—CHCl—COOH + HCl
CH3—CHCl—COOH + HCl
2 стадия
CH3—CHCl—COOH + 2NH3 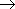 CH3—CH(NH2)—COOH + NH4Cl
CH3—CH(NH2)—COOH + NH4Cl
 2020-06-29
2020-06-29 104
104








