Для оценки воздействия техногенного загрязнения окружающей среды на здоровье населения урбанизированных регионов целесообразно применение современных методик оценки экологического риска.
Практическая потребность анализа и управления экологическим риском закономерно проявилась в России на рубеже XX_XXI вв. как основа принятия эффективных решений и целевых программ по устойчивому эколого-экономическому развитию крупных градопромышленных агломераций и обеспечению экологической безопасности населения. Концепция риска основана на том, что наличие в окружающей среде потенциально опасных химических веществ и других вредных экологических факторов создает угрозу здоровью человека – степень реальной опасности. Ключевое звено в данной концепции – здоровье человека и его охрана от вредного воздействия (снижение уровня риска) на основе анализа, выявления и устранения факторов риска.
Риск для здоровья – вероятность развития угрозы жизни или здоровью человека либо угрозы жизни или здоровью будущих поколений, обусловленная воздействием факторов среды обитания.
Под факторами риска здоровью понимаются факторы, провоцирующие или увеличивающие риск развития определенных заболеваний. Применительно к неблагоприятному воздействию окружающей среды выделяют факторы среды обитания, к которым относят биологические (вирусные, бактериальные, паразитарные и иные), химические (загрязняющие вещества), физические (шум, вибрация, ультразвук, инфразвук, тепловые, ионизирующие, неионизирующие и иные излучения), социальные (питание, водоснабжение, условия быта, труда, отдыха) и иные факторы среды обитания, оказывающие воздействие на человека.
Оценка риска для здоровья – это процесс установления вероятности развития и степени выраженности неблагоприятных последствий для здоровья человека или здоровья будущих поколении, обусловленных воздействием факторов среды обитания.
В последние годы быстро развивается новое научное направление, базирующееся на теории риска для здоровья, связанного с химическим загрязнением окружающей среды. Оно получило развитие на базе совместных разработок Федерального центра гигиены им. Ф.Ф. Эрисмана, Федерального Центра экологической политики России и Американского агентства по охране окружающей среды (U.S. ЕРА). Базируясь на этой методологии, возможно идентифицировать и количественно оценивать уровни риска, а также планировать меры по организации мониторинга окружающей среды и снижению риска в экологически неблагополучных районах.
Основные положения этой методологии оценки риска здоровью населения закреплены в руководстве Р 2.1 10.19-2004 «Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду» (утверждено главным государственным санитарным врачом РФ 05.03.2004 г.).
В соответствии с данным «Руководством» процедуру оценки риска для здоровья населения, обусловленного воздействием химических загрязнителей среды обитания, можно подразделить на пять взаимосвязанных этапов.
1. Идентификация опасности: выявление потенциально вредных факторов, оценка связи между изучаемым фактором и нарушениями состояния здоровья человека, достаточности и надежности имеющихся данных об уровнях загрязнения различных объектов окружающей среды исследуемыми веществами; составление перечня приоритетных химических веществ, подлежащих последующей характеристике.
2. Оценка воздействия (экспозиции) химических веществ на человека: характеристика источников загрязнения, маршрутов движения загрязняющих веществ от источника к человеку, путей и точек воздействия; определение доз и концентраций, воздействовавших в прошлом, воздействующих в настоящем или тех, которые, возможно, будут воздействовать в будущем; установление уровней экспозиции для популяции в целом и ее отдельных субпопуляций, включая сверхчувствительные группы.
3. Оценка зависимости «доза-ответ»: выявление количественных связей между показателями состояния здоровья и уровнями экспозиции. Для этого, как правило, используются экспериментальные данные (токсикологический эксперимент, спланированное эпидемиолого-гигиеническое исследование и др.).
4. Характеристика риска: анализ всех полученных данных; расчет рисков для популяции и её отдельных подгрупп; сравнение рисков с допустимыми (приемлемыми) уровнями; сравнительная оценка и ранжирование различных рисков по степени их статистической, медико-биологической и социальной значимости; установление медицинских приоритетов и тех рисков, которые должны быть предотвращены или снижены до приемлемого уровня.
5. Управление риском: заключительный этап, связанный с мероприятиями по минимизации риска, которые осуществляются на основе выявленных приоритетов.
Все эффекты воздействия на организм человека с точки зрения ответной реакции экспонированного населения можно с некоторой долей условности разделить на две основные группы:
- канцерогенные;
- неканцерогенные (общетоксические).
Типичные графические модели «доза-ответ (эффект)» иллюстрирует рис. 4.1. По оси абсцисс (X) – доза (концентрация) воздействующего вредного фактора; по оси ординат (У) – эффект (ответный отклик, т.е. % заболевших или лиц, у которых проявился токсический эффект от общего числа экспонированных лиц).
Под канцерогеном понимают любой химический, физический или биологический агент, способный вызвать развитие рака (злокачественной опухоли), а под канцерогенным эффектом – возникновение злокачественных новообразований при воздействии факторов окружающей среды. Известно, что канцерогенные эффекты приближаются к прямой (линейной) зависимости (см. рис.4.1, А): чем выше доза, тем сильнее эффект (тяжелые металлы, бенз(а)пирен). Определенный порог есть всегда (в малых дозах и радиация безвредна), но для канцерогенов он довольно низок. Как правило, канцерогены вызывают также побочные неканцерогенные эффекты.
Неканцерогенный эффект характеризует возрастание вероятности развития заболеваний различной природы, за исключением канцерогенных, и в отличие от канцерогенного эффекта проявляется по типу порогового эффекта, когда после определенного уровня воздействия эффект становится достоверным (проявляется не менее, чем у 1/6 части популяции, т.е. у 16,7 % экспонированных лиц). Рост патологических реакций проявляется по экспоненциальному закону, графическая модель напоминает сигмоидальную кривую (рис.4.1, Б).
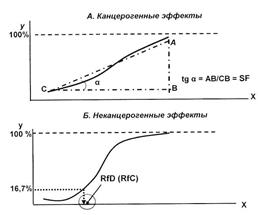
Рис. 4.1. Типичные модели «доза – эффект» (сплошная линия – зависимость возрастания числа токсических эффектов при увеличении воздействующей дозы вредного фактора)
SF – фактор канцерогенного потенциала (мг/(кг·сутки))-1 – мера дополнительного индивидуального канцерогенного риска или степень увеличения вероятности развития рака при воздействии канцерогена. Определяется как тангенс угла наклона зависимости «доза – эффект» в нижней «линейной» части экспериментальной кривой. Факторы наклона канцерогенного потенциала разработаны в экспериментальных исследованиях на животных на основе использования линейной многоступенчатой модели и с учетом статистической экстраполяции с высоких доз, где наблюдаются эффекты в лабораторных условиях, на малые дозы, реально встречающиеся в объектах окружающей среды, при которых эффект в эксперименте не выявляется. Фактор канцерогенного потенциала – табличная (справочная) величина, определяемая экспериментальным путем с последующим применением математических методов экстраполяции воздействия «высоких» доз на воздействие «низких».
RfD – референтная доза – это суточное воздействие химического вещества в течение всей жизни, которое не приводит к возникновению неприемлемого риска для здоровья (RfC -концентрация). Как и фактор канцерогенного потенциала – это справочные величины.
Бывают эффекты особого рода (эффекты оптимума), которые проявляются особым образом, например, когда существует оптимальная доза, любые отклонения от которой вредны и вызывают патологические реакции (примеры: микроэлементозы – болезни, связанные с балансом макро- и микроэлементов (недостаток фтора способствует развитию кариеса)). Эффекты оптимума отражают видовую толерантность к воздействующему вредному фактору и типичны для большинства эссенциальных веществ, присутствующих в организме в микродозах. Однако, в «Руководстве по оценке риска» такие эффекты не рассматриваются.
Токсические эффекты могут иметь латентный период (контакт с фосфорорганическими пестицидами может приводить к ограничению подвижности и параличу нижних конечностей через несколько месяцев после контакта; длительное вдыхание паров асбеста может приводить к развитию рака легких спустя 20_25 лет).
Вредные эффекты характеризуют по локализации: поражение ЦНС, желудочно-кишечного тракта, органов кроветворения, репродуктивной системы и т.д. Критические органы и системы – те органы (системы), которые наиболее чувствительны к действию наименьших из эффективных доз или концентраций химических веществ; причем, при одновременном поражении нескольких органов эффекты носят название «системные эффекты». Так, для воздействующих аэрогенным путем диоксида азота критическими будут органы дыхания, фенола – органы дыхания и глаза, толуола – ЦНС.
Таким образом, модели зависимости «доза – эффект» отражают основные количественные закономерности между воздействующей дозой и частотой вредных эффектов в экспонированной популяции.
Уровень реакции организма зависит от дозы. Чем выше доза, тем больший процент населения реагирует на химическое воздействие и тем тяжелее реакция. Для канцерогенных эффектов пороговые дозы не признаются, а эффекты имеют линейный характер. Неканцерогенный эффект проявляется только после достижения пороговых (референтных) доз, а достоверным эффект считается в случае, если он проявляется не менее, чем у 16,7 % части экспонированной популяции.
При оценке риска потенциальные дозы загрязняющих веществ, как правило, усредняются с учетом массы тела и времени воздействия. Такая доза носит название средней суточной дозы (ADD). При этом обычно принимается допущение, что в среднем суточное потребление атмосферного воздуха для взрослого человека составляет 20 м3/сутки, а потребление питьевой воды – 2 л.
В «Руководстве по оценке риска» приведен расчет среднесуточных доз при ингаляционном воздействии загрязняющих веществ, поступающих с атмосферным воздухом, проводится по формуле (4.1):
ADD= ((Ca·Tout·Vout)+(Ch · Tin·Vin))· EF·ED /(BW·AT· 365) (4.1)
При этом, как правило, принимаются стандартные значения показателей (факторов экспозиции), приведенные в табл. 4.2.
Пример: рассчитать среднесуточную дозу поступления в организм диоксида азота при ингаляционном воздействии с атмосферным воздухом для детского и взрослого населения, если его среднесуточная концентрация в атмосферном воздухе составляет 0,05 мг/м3, а в воздухе жилого помещения – 0,04 мг/м3.
С использованием стандартных значений показателей имеем:
- для взрослого населения:
ADD = ((0,05·8·1,4)+(0,04·16·0,63))·350·30/(70·30·365) = 0,013 мг/кг в сутки;
- для детского населения:
ADD = ((0,05·8·1,4)+(0,04·16·0,63))·350·6/(15·6·365) = 0,062 мг/кг в сутки.
В «Руководстве по оценке риска» приведены также стандартные формулы для расчета средней суточной дозы и стандартные значения факторов экспозиции:
- при пероральном поступлении химических веществ в организм с питьевой водой;
- при пероральном поступлении химических веществ в организм с продуктами питания (при использовании методов индивидуального потребления продуктов питания);
- при ингаляционном поступлении химических веществ, испаряющихся из питьевой воды;
- при накожной экспозиции водопроводной (питьевой) воды (поглощенная доза);
- при поступлении химических веществ для детей первого года жизни с грудным молоком и продуктами прикорма;
- при пероральном поступлении веществ из почвы (для детей дошкольного возраста);
- при ингаляционном воздействии химических веществ, попадающих в воздух из почвы;
- при накожной экспозиции почвы.
Таблица 4.2
 2020-06-29
2020-06-29 110
110








