В процессе жизнедеятельности в любом живом организме совершаются сложнейшие и многообразные превращения химических веществ различной природы. Большинство из них протекают с участием биологических катализаторов белковой природы – ферментов. Ферменты ускоряют реакции в миллиарды и триллионы раз при комнатной температуре. При повышении температуры они теряют свою активность. Т.к. происходит денатурация белков.
Ферментативный катализ имеет характерные особенности:
· высокая активность. По активности биологические катализаторы в миллионы раз превосходят активность химических катализаторов.
· высокая специфичность. Каждый из них действует лишь на строго определенную реакцию или группу реакций. Например, амилаза катализирует процесс расщепления крахмала, состоящего из одинаковых глюкозных звеньев. Но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
· высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. Ферменты активны лишь в узком интервале рН и Т, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН и Т; по обе стороны от этого значения активность ферментов быстро снижается.
· В процессе каталитической реакции фермент постепенно разрушается и утрачивает свою активность. Это явление получило название инактивация.
В последние годы интенсивно развиваются исследования свойств иммобилизованных ферментов, т.е. ферментов, закрепленных на твердых носителях, что дает возможность легко отделять катализатор от продуктов реакции и использовать его многократно.
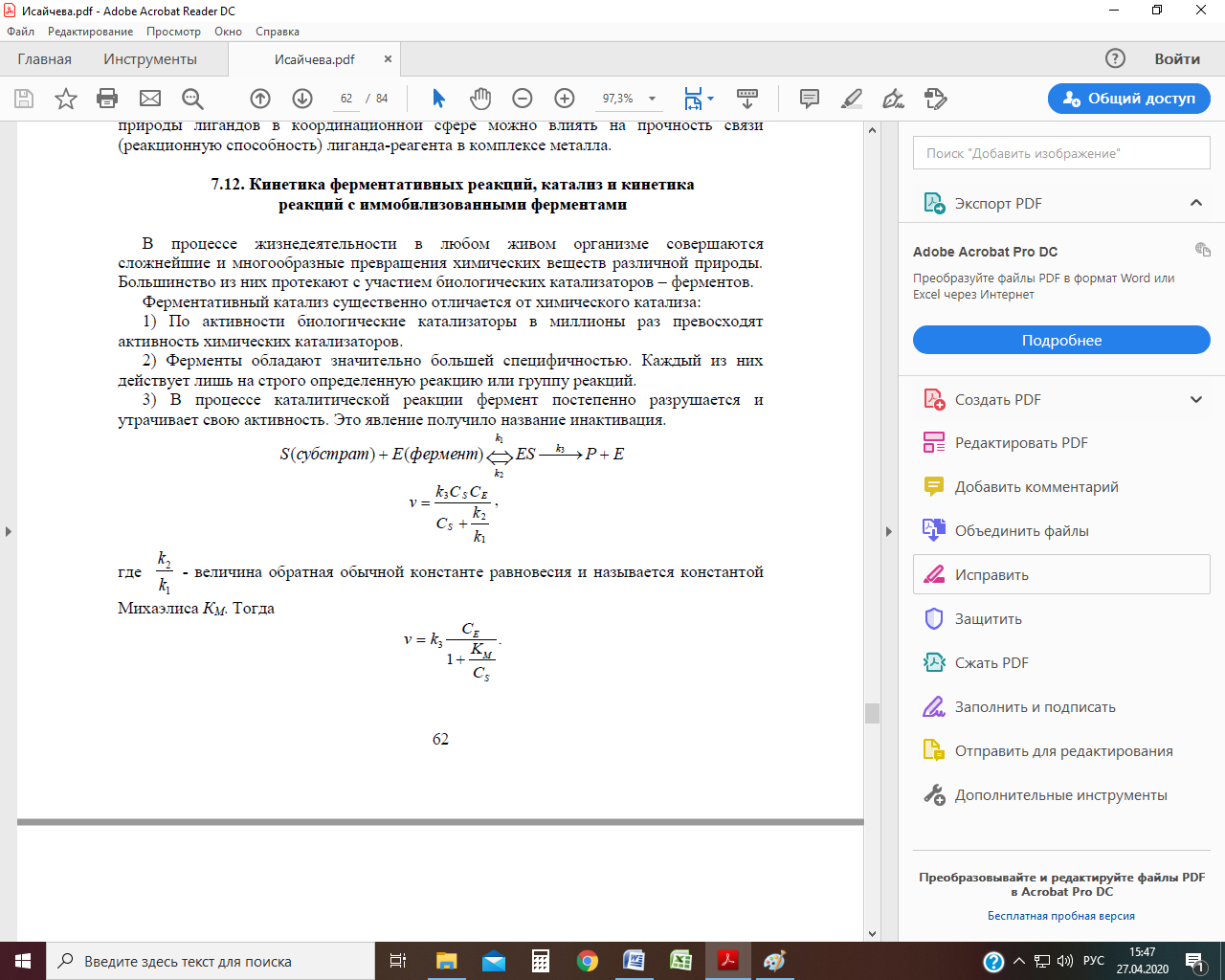
где k2 / k1 - величина обратная обычной константе равновесия и называется константой Михаэлиса КМ. Тогда

Максимальная скорость достигается тогда, когда концентрация субстрата безгранично растет: v max = k3 · CE и тогда
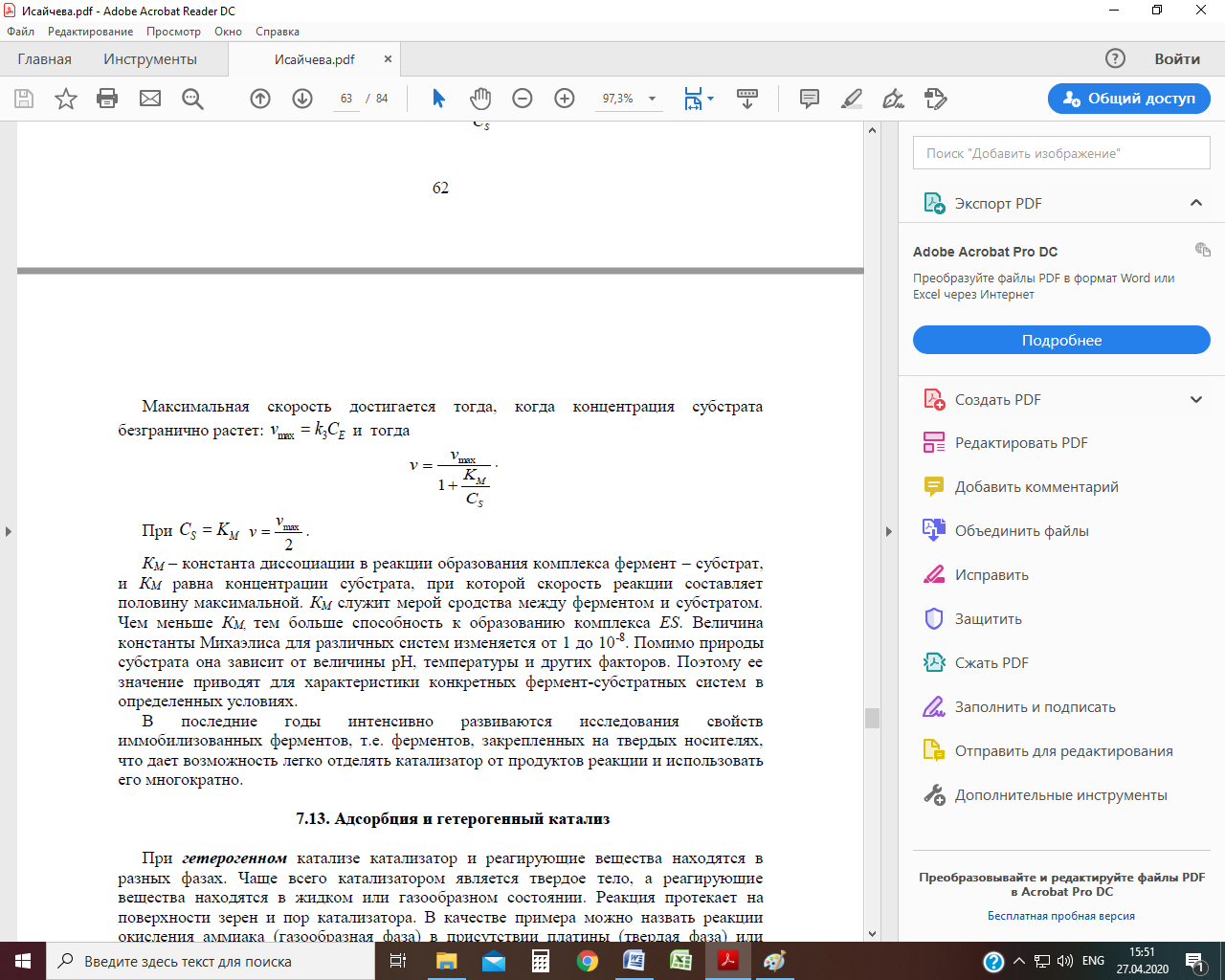
При 
КМ – константа диссоциации в реакции образования комплекса фермент – субстрат,
и КМ равна концентрации субстрата, при которой скорость реакции составляет половину максимальной.
КМ служит мерой сродства между ферментом и субстратом. Чем меньше КМ, тем больше способность к образованию комплекса ES.
Величина константы Михаэлиса для различных систем изменяется от 1 до 10-8. Помимо природы субстрата она зависит от величины рН, температуры и других факторов. Поэтому ее значение приводят для характеристики конкретных фермент-субстратных систем в определенных условиях.
Катализ имеет огромное значение в технике и природе. Подбирая соответствующим образом катализаторы, можно осуществлять процессы в желаемом направлении и с нужной скоростью. Область применения каталитических реакций в химической промышленности в настоящее время совершенно необозрима. Такие важные процессы, как производство серной кислоты, синтез аммиака, окисление аммиака до азотной кислоты, переработка нефти, синтез каучука и полимерных материалов и многие другие являются каталитическими.
 2020-06-29
2020-06-29 101
101







