План ответа на вопрос
1. Молекулярная формула и строение молекулы крахмала
2. Нахождение в природе и физические свойства
3. Химический состав и практическое применение крахмала
Молекулярная формула крахмала (C6H10O5)n, крахмал относится к классу углеводов. Это природный полимер. Молекула крахмала состоит из большого числа соединенных между собой остатков a- глюкозы. Количество звеньев достигает нескольких тысяч. Молекула может иметь линейное и разветвленное строение.
Крахмал – белое, кристаллическое вещество не растворимое в холодной воде. В горячей – образует клейстер. Больше всего крахмала в зернах риса – 80%, в зернах пшеницы и кукурузы около 70%, в клубнях картофеля – около 20%.
Качественной реакцией на крахмал является взаимодействие с йодом – наблюдается темно-синяя окраска. Крахмал подвергается гидролизу
(C6H10O5)n + nH2O ® n(C6H12O6)n
крахмал глюкоза
Гидролиз крахмала идет ступенчато: на первом этапе из крахмала образуется декстрин, затем дисахарид мальтоза и конечным продуктом гидролиза является глюкоза.
Крахмал – ценное питательное вещество, он является основным углеводом нашей пищи. Крахмал используется для производства декстрина и патоки. В быту крахмал используют для приготовления клейстера и накрахмаливания белья.
Вопрос 3. Получить гидроксид цинка и провести реакции, подтверждающие его свойства.
В пробирку наливаем 2 мл. хлорида цинка и по каплям добавляем гидроксид натрия до образования осадка.
ZnCl2 + 2NaOH ® Zn(OH)2¯ + 2NaCl
Zn2+ + 2OH- ® Zn(OH)2 ¯
Полученный осадок разделить на 2 части, в одну – приливаем соляную кислоту до растворения осадка.
Zn(OH)2 + 2HCl ® ZnCl2 + 2H2O
Zn(OH)2 + 2H+ ® Zn2+ + 2H2O
Во вторую приливаем щелочь до полного растворения осадка
Zn(OH)2 + 2NaOH ® Na2ZnO2 + 2H2O
Zn(OH)2 + 2OH- ® ZnO22- + 2H2O
Билет 18
Вопрос 1. Химическая и электрохимическая коррозия металлов. Условия, при которых происходит коррозия, меры защиты от коррозии.
План ответа на вопрос
1. Понятие коррозии
2. Химическая коррозия
3. Электрохимическая коррозия
4. Методы защиты от коррозии
Коррозия – это процесс самопроизвольного разрушения металлов под воздействием окружающей среды.
Коррозия – это окислительно-восстановительный процесс. В зависимости от среды, в которой он протекает различают несколько видов коррозии. Наиболее часто встречается химическая и электрохимическая коррозии.
Химическая коррозия – происходит в непроводящей ток среде. Такой вид коррозии наблюдается при взаимодействии металлов с сухими газами или жидкостями – не электролитами (например, бензин, керосин и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин и т.д. Химическая коррозия часто проявляется при обработке металлов при высоких температурах. Например:
t
2Fe + 3SO2 + 3O2 ® Fe2(SO4)3
t
2Fe + 3Cl2 ® 2FeCl3
Большинство металлов окисляются кислородом воздуха и на их поверхностях образуются оксидные пленки. У одних металлов (Cr, Al, Zn, Ni и др.) оксидные пленки прочно и хорошо связаны с металлом и они защищают металл от разрушения. У других - пористая и не способна защитить от коррозии.
Электрохимическая коррозия. Происходит в проводящей ток среде (электролите) с возникновением в системе в системе электрического тока. Как правило, металлы и их сплавы не однородны и содержат включения других веществ. При попадании такого металла в среду электролита будет возникать гальванический элемент, в котором одни участки поверхности будут играть роль анода (отдавать электроны), а другие роль катода (принимать электроны). Например, если железная конструкция соприкасается с медной, будет возникать гальванический элемент, в котором более активное железо является анодом и разрушается
A(-) Fe0 - 2ē ® Fe2+
Менее активная медь будет являться катодом. В зависимости от среды на катоде будут идти разные процессы.
В кислой среде на поверхности медного катода будет восстанавливаться водород
К(+) 2Н+ + 2ē ® Н20
И суммарное уравнение реакции процесса будет иметь вид:
Fe0 + 2H+ ® Fe2+ + Н20
В нейтральной среде на аноде восстанавливается водород, растворенный в воде
O2 + 2H2O +4ē ® 4OН-
Далее ионы железа Fe2+ соединяются с гидроксидионами
Fe2+ +2OН-® Fe(ОН)2
Образовавшийся Fe(ОН)2 в присутствии кислорода и воды превращается в Fe(ОН)3
4 Fe(ОН)2 +2H2O + O2 ® 4Fe(ОН)3
Катионы водорода и растворенный в воде кислород – важнейшие окислители, вызывающие электрохимическую коррозию. Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности. Коррозия значительно усиливается при повышении температуры.
Способы защиты от коррозии
1. Шлифование поверхностей изделия, чтобы на них не скапливалась влага.
2. Применение легированных сплавов, содержащих специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют оксидный слой.
3. Нанесение защитных покрытий
o Неметаллических - лаки, краски, эмали, смазки;
o Металлических – хромирование, никелирование, лужение, цинкование;
4. Электрохимические методы
o Протекторная (анодная) к защищаемой металлической конструкции присоединяется кусок более активного металла, который будет являться анодом и разрушаться;
o Катодная – металлоконструкцию присоединяют к катоду внешнего источника тока, что исключает возможность ее разрушения.
Вопрос 2. Аминокислоты, их состав и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
План ответа на вопрос
1. Понятие аминокислот
2. Строение молекулы, изомерия и аминокислот
3. Физические и химические свойства
4. Биологическая роль аминокислот
Аминокислоты – это азотсодержащие органические вещества, в молекулах которых содержатся карбонильная и аминогруппа.
NH2 – CH2 ¾ COOH NH2 – CH2 – CH2 ¾ COOH
Аминоуксусная кислота аминопронионовая кислота
В молекуле аминокислот имеется аминогруппа (-CH2), которая придает аминокислотам основные свойства и карбоксильная группа (-СООН), которая придает им кислотные свойства. Изомерия аминокислот, в основном, зависит от различного строения углеродной цепи и положения аминогруппы.
CH3
½
CH3 –– CH – COOH CH3 – C – COOH
½ ½
NH2 NH2
a - аминобутоновая кислота a - амино - a - метилпропионовая кислота
CH3 –– CH – CH2 –– COOH
½
NH2
b - аминопропиановая кислота
Физические свойства
Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в воде, сладкие на вкус.
Химические свойства
1. Свойства по аминогруппе: взаимодействуют с соляной кислотой
NH2 CH2 COOH + HCl ® NH3 ClCH2 COOH
2. Свойства по карбоксильной группе: взаимодействуют со щелочами
NH2 CH2 COOH + NaOH ® NH2 CH2 COONa + H2O
3.
O H O H
½½ ½ ½½ ½
NH2 CH2 C + N – CH - COOH ® H2O + NH2 CH2 - C - N - CH2 – COOH
OH H CH3 CH3
O H
½½ ½
- C N - - пептидная группа, которая встречается в молекулах белков
Аминокислоты необходимы для синтеза белковых молекул в живых организмах. Нужные для этого аминокислоты человек получает с пищей. Для этой цели успешно используются также искусственно выделенные или синтезированные аминокислоты. Некоторые из них применяются в медицинских целях. Некоторые производные аминокислот используют для производства химических волокон (капрон).
Вопрос 3. Определить объем водорода, который выделяется при взаимодействии цинка с раствором соляной кислоты m=36.5 г.
| Дано: m (HCl) = 36.5г. | Решение: |
 V(H2) -? V(H2) -?
|
1 моль х
2HCl + Zn ® ZnCl 2 +H2
2 моль 1 моль
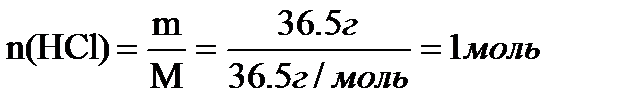 Соотношение HCl и Zn в уравнении реакции 2:1, следовательно из 1 моль HCl получится 0,5 моль Н2
Соотношение HCl и Zn в уравнении реакции 2:1, следовательно из 1 моль HCl получится 0,5 моль Н2
|
 V(H2) = Vm * n = 22.4 моль * 0,5 моль = 11,2 л
V(H2) = Vm * n = 22.4 моль * 0,5 моль = 11,2 л
Билет 19
Вопрос 1. Окислительно-восстановительные реакции (на примере взаимодействия алюминия с оксидами некоторых металлов, концентрированной серной кислоты с медью).
План ответа на вопрос
1. Понятие окислительно-восстановительной реакции, окислитель и восстановитель
2. Взаимодействие алюминия с оксидами металлов
3. Взаимодействие концентрированной серной кислоты с медью.
Окислительно-восстановительными называются реакции, в результате которых все или некоторые элементы, входящие в состав исходных веществ и продуктов реакции меняют свои степени окисления.
Например:
2Cu0 +O20 ® 2Cu+2O-2
В процессе окислительно-восстановительной реакции происходит перераспределение электронов, что и приводит к изменению степеней окисления некоторых элементов. Атом или ион, который отдает электроны и повышает свою степень окисления, называется восстановителем, а процесс окислением.
Cu0 - 2ē ® 2Cu+2
Окислителем называется атом или ион, который принимает электроны и понижает свою степень окисления. Процесс принятия электронов называется восстановлением.
O0 + 2ē ® O-2
В реакциях алюминия с оксидами некоторых металлов алюминий выступает в качестве восстановителя, а ион металла в оксиде в качестве окислителя, например,
2Al + Cr2O3 ® Al2O3 + 2Cr
Al0 - 3ē ® Al3+ окисление
восстановитель
Сr3+ + 3ē ® Сr0 восстановления
окислитель
Получение металлов из оксидов с помощью алюминия называют алюминотермией. Концентрированная серная кислота очень сильный окислитель. Она реагирует почти со всеми металлами (кроме золота и платины) и с некоторыми неметаллами.
Медь в электрохимическом ряду напряжения металлов стоит после водорода, а, следовательно, не может быть им окислена. При взаимодействии меди с концентрированной серной кислотой окислителем будет являться S+6.
+6 +2 +4
Cu0 + 2H2SO4 ® CuSO2 + SO2 + 2H2O
Cu0 - 2ē ® Cu+2 окисление
восстановитель
S+6 + 2ē ® S+4 восстановление
окислитель
Вопрос 2. Анилин – представитель аминов, химическое строение и свойства, получение и практическое значение.
План ответа на вопрос
1. Строение молекулы анилина.
2. Физические и химические свойства
3. Получение
4. Применение
C6H5 – NH2 – анилин
HC HC
..
HC C – NH2
CH CH
В результате взаимного влияния аминогруппы и бензольного ядра основные свойства аминогруппы выражены слабее, чем у аммиака. В тоже время под влиянием аминогруппы электронная плотность в напряжениях 2, 4, 6 повышена, что усиливает подвижность атомов водорода в реакциях замещения.
Физические свойства
Анилин – бесцветная маслянистая жидкость малорастворимая в воде, t0пл = -60С, t0кип = 1740С. Анилин ядовит.
Химические свойства
- Свойства по аминогруппе: взаимодействует с соляной кислотой
C6H5NH2 + HCl → C6H5NH3Cl
Хлорид фениламмония
- Свойства по бензольному ядру: вступает в реакции замещения с бромной водой
HC HC CH CBr
HC C – NH2 + 3Br2 → BrC C – NH2 + 3HBr
CH CH CH CBr
2, 4, 6 - триброманелин
Получение
В промышленности анилин получают по реакции восстановления нитробензола, которую в 1842г. Провел русский химик Н.И. Зимин. Нитробензол восстанавливают железными стружками в присутствии соляной кислоты. Вначале выделяется атомарный водород, который затем и взаимодействует с нитробензолом.
Fe + 2HCl → FeCl2 + 2H
C6H5NO2 +6H → C6H5NH2 + 2H2O
Применение
Анилин используется для получения красителей, пластмасс, лекарственных веществ, взрывчатых веществ.
Вопрос 3. Доказать принадлежность глюкозы к многоатомным спиртам и альдегидам.
Глюкоза – альдегидоспирт. Наличие в молекуле глюкозы гидроксогррупп можно доказать, если провести реакцию с Cu(OH)2; наблюдается темно-синее окрашивание раствора.
В пробирку наливаем 1 мл. свежеприготовленного раствора глюкозы и добавляем 1-2 капли CuSO4 и 1-2 капли раствора NaOH. Раствор окрашивается в синий цвет. Наличие карбонильной группы можно доказать реакцией «серебряного зеркала».
В пробирку наливаем 1 мл раствора глюкозы, добавляем 2-3 капли раствора AgNO3 и 3 капли раствора аммиака. Аккуратно нагреваем на пламени спиртовки. На стенках пробирки образуется серебряный налет.
O t
CH2OH(CHOH)4 – C + Ag2O ® CH2OH(CHOH)4 – COOH + 2Ag¯
H
Глюкоза глюконовая кислота
Билет 20
Вопрос 1. Окислительно-восстановительные свойства серы и ее соединений.
План ответа на вопрос.
- Положение серы в периодической системе, строение атома.
- Свойства серы – простого вещества.
- Характеристика окислительно-восстановительных свойств соединений серы в разной степени окисления.
| ¯ |
3S
| ¯ |
 ē 1S22S22p63S23p4
ē 1S22S22p63S23p4
Простое вещество сера – неметалл. В химических реакциях S0 может быть и окислителем и восстановителем. С металлами сера выступает в качестве окислителя:
S0 + Fe0 ® Fe+2S-2
S0 + 2ē ® S-2 - восстановление
Окислитель
Fe0 - 2ē ® FeS+2 - окислитель
восстановитель
В реакциях с неметаллами, имеющими относительную электронноотрицательность меньше, чем у серы, она также проявляет окислительные свойства, например, с водородом
H2 + S ® H2+S-2
S0 + 2ē ® S-2 - восстановление
Окислитель
H20 - 2ē ® 2H+ - окисление
восстановитель
С неметаллами, имеющими относительную электроотрицательность выше, чем у серы, она является восстановителем.
+4
S0 + O2 ® SO2-2
S0 + 4ē ® S+4 - окисление
восстановитель
O20 - 4ē ® 2O-2 - восстановление
окислитель
В соединениях сера может проявлять степени окисления: -2, +4, +6. Соединения S-2 могут быть только восстановителями
+4
2H2S-2 + 3O2 ® 2H2O + 2SO2
S-2 - 6ē ® S+4 – окисление
восстановитель
Соединения серы S+4 могут проявлять и окислительные и восстановительные свойства:
S+4O2 – 2H2S → 3S0↓ + 2H2O
S+4 + 4ē ® S0 – восстановление
Окислитель
+4 +6
2SO2 + O2 → 2SO3
S+4 - 2ē ® S+6 – окисление
восстановитель
Соединения S+6 проявляют окислительные свойства:
2H2S+6O4 + Cu ® CuSO4 + S+4O2 +2H2O
S+6 + 2ē ® S+4 – восстановление
окислитель
Вопрос 2. Взаимосвязь между важнейшими классами органических веществ.
| 8 ® 9 |
| 7 ® |
| 5 ® 6 |
| 3 ® 4 |
| 2 ® 1 |
Алканы алкены спирты альдегиды карбонов. сложный
Кислота эфир
O
Cu4 C2H4 C2H5OH CH3 – C CH3COOH CH3COOCH3
H
1. Дегидрирование алканов
t
2CH4 ® H2C = CH2 + 2H2
2. Гидрирование
kat
H2C = CH2 + H2 ® H3C – CH3
3. Гидратация
H3PO4
H2C = CH2 + H2O ® CH3CH2OH
4. Дегидратация
t H2SO4
C2H5OH ® C2H4 + H2O
5. Окисление
t O
C2H5OH + CuO ® CH3 – C + Cu + H2O
H
6. Восстановление
O t kat
CH3 - C + H2 ® CH3CH2OH
H
7. Окисление
O kat O
2CH3 - C + O2 ® 2CH3C
H ОH
8. этерификация
O t H2SO4 O
CH3 - C + CH3OH ® CH3 – C + H2O
OH O – CH3
9. Гидролиз
O t O
CH3 - C + H2O ® CH3 – C + CH3OH
O - CH3 OH
Вопрос 3. При соединении 4,2 г. железа с серой выделилась теплота, равная 7,15 кДж. Вычислите тепловой эффект данной реакции.
| Дано: m (Fe) = 4.2г. Q=7.15 кДж | Решение: |
 Q -? Q -?
|
0.075 моль 7,15кДж
Fe + S ® FeS +Q
1 моль

 Ответ: Q = 95,33кДж
Ответ: Q = 95,33кДж
|
Билет 21.
Вопрос 1. Железо: положение в периодической системе Д.И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами растворами кислот и солей. Сплавы железа.
План ответа на вопрос.
1. Положение железа в периодической системе, строение атома, возможные степени окисления.
2. Физические свойства
3. Химические свойства: взаимодействие с кислородом, галогенами, растворами кислот и солей.
4. Сплавы железа.
Железо – элемент восьмой группы, побочной подгруппы, IV периода.
| 4S |
| ¯ |
| ¯ |
 ē
ē 
В соединениях железо проявляет степени окисления: +2, +3 и реже +6.
Физические свойства
Чистое железо – серебристо-белый металл, пластичный, r - 7,87 г/см3, tпл = 15390С. Обладает магнитными свойствами.
Химические свойства.
1. Взаимодействует с кислородом
t
3Fe + 2O2 ® Fe3O4 (Fe2O3. FeO)
2. Взаимодействует с галогенами
2Fe + 3Cl2 ® 2FeCl3
3. Взаимодействует с кислотами
Fe + 2HCl2 ® FeCl2 + H2
4. Вытесняет менее активные металлы из состава солей
Fe + CuSO4 ® Cu + FeSO4
Сплавы железа
Основные сплавы железа – это чугуны и стали. Чугун – это сплав железа с углеродом, в котором углерода более 1,8%. Чугун используется для производства станин для станков, плит, труб и др., а также он является сырьем для производства сталей.
Стали содержат от 0,2 до 1,8 % углерода. Стали могут быть углеродистые и легированные. На долю углеродистых сталей приходится 90% всего производства стали. Углеродистые стали используются в машиностроении (корпусы машин, проволока, болты, гайки и т.д.), для изготовления инструментов (сверла, ножи и т.д.).
Легированные стали делятся на нержавеющие (содержат хром и никель), инструментальные (содержат вольфрам и марганец), кремниевые (используются для изготовления электрооборудования).
Вопрос 2. Белки, как полимеры. Свойства и биологические функции белков.
План ответа на вопрос.
1. Белки – как природные полимеры.
2. Состав и строение белков.
3. Структура и физические свойства белков.
4. Химические свойства.
5. Функции белков
Белки – это азотосодержащие высокомолекулярные органические вещества, состоящие из остатков a- аминокислот. В состав кислот входят углерод, водород, кислород и азот. Большинство белков содержат также серу, а иногда фосфор, железо и некоторые другие элементы. Белки имеют очень большую молекулярную массу.
В 1888 году русский биохимик А.Я. Данилевский установил, что в состав белка входит многократно повторяющаяся пептидная группа:
O H
½½ ½
- C – N -
В молекулах белков аминокислотные остатки повторяются многократно в строгой последовательности. Эта последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белковой молекулы.
Пространственная конфигурация белковой молекулы, напоминающая спираль, образует благодаря многочисленным водородным связям, которые имеются между группами
– СО – и – NH -
Такая структура белка называется вторичной.
В пространстве закрученная в спираль полипептидная цепь образует третичную структуру белка. Она поддерживается взаимодействием разных функциональных групп полипептидной цепи. По характеру «упаковки» белки третичной группы могут быть глобулярными (шаровидными), например, белок куриного яйца, и фибрилярными (нитевидными), например, белок мыши.
Глобулярные белки хорошо растворимы в воде и являются слабыми электролитами. Фибрилярные белки в воде нерастворимы.
Химические свойства
1. Белки подвергаются денатурации. При действии на белок спиртов, солей тяжелых металлов, а также при нагревании и встряхивании белки разрушаются и образуют осадки.
2. Цветные реакции на белки:
а) биуретовая реакция: если на белок подействовать свежеприготовленным Cu(OH)2, то раствор окрашивается в фиолетовый цвет.
б) ксантопротеиновая: при действии на белок концентрированной азотной кислоты выпадает белый осадок, который при нагревании окрашивается в желтый цвет, а при добавлении раствора аммиака – в оранжевый.
3. Белки подвергаются гидролизу в щелочной и кислой среде.
O H
½½ ½ H+
NH2 – CH2 – C – N – CH – COOH - H – OH ® NH2 – CH2 – COOH + NH2 – CH - COOH
½ ½
CH3 CH3
Функции белков
1. Строительная – белки являются основным строительным материалом животных клеток.
2. Регуляторная – некоторые белки являются гормонами и осуществляют регулирование биохимических реакций в организме.
3. Каталитическая – некоторые белки являются катализаторами биохимических реакций в организме.
4. Транспортная – белки участвуют в переносе различных веществ в организме, например, гемоглобин осуществляет перенос кислорода от легких к тканям.
5. Энергетическая – при расщеплении белков в организме выделяется большое количество энергии.
Вопрос 3. Даны растворы хлорида, бромида и йодида натрия. Определите данные вещества с помощью характерных реакций.
Выданные вещества разделить на две части. Одну часть оставить в качестве контрольной.
Во вторую часть растворов добавить раствор AgNO3. В пробирке с NaCl выпадает белый осадок:
NaCl + AgNO3 ® AgCl¯ + NaNO3
Ag+ + Cl- ® AgCl¯
В пробирке с NaBr выпадает светло-желтый осадок:
NaBr + AgNO3 ® AgBr¯ + NaNO3
Br- + Ag+ ® AgBr¯
В пробирке с NaJ выпадает желтый осадок:
NaI + AgNO3 ® AgI¯ + NaNO3
I- + Ag+ ® AgI¯
Билет 22
Вопрос 1. Проблема защиты окружающей среды от загрязнения.
Непрерывное развитие химического производства, энергетики, возрастание потребления угля, нефти и газа в промышленности и на бытовые нужды увеличивает опасность загрязнения окружающей среды.
Поэтому большое значение приобретает охрана окружающей среды от загрязнения вторичными продуктами химической переработки. Причины загрязнения могут быть различными: утечка нефти при перевозке ее всеми видами транспорта, ПЫЛЬ, образующаяся при измельчении серосодержащего сырья и др. Вес это очень опасно как для окружающей среды, так и для здоровья человека.
Например, нефть, растекаясь тонким слоем по поверхности воды, нарушает ее газообмен с атмосферой, лишая растительные и животные организмы акватории нормальных условий жизнедеятельности; сернистые и азотcосодержащие вещества, при сгорании образующие оксиды серы и азота, вызывают коррозию металлов и губительно действуют на все живое.
Сжигание топлива сопровождается выделением в атмосферу углекислого газа. За последние 20 лет содержание углекислого газа в атмосфере Земли увеличилось примерно на 5%. При всей кажущейся малости этой цифры, если содержание CО2 в атмосфере будет расти и дальше, в будущем Земле может грозить повышение температуры до пределов, когда жизнь на ней существовать не сможет. Это вызвано тем, что атмосфера с высоким содержанием CО2 поглощает тепловое излучение, испускаемое поверхностью Земли.
Для предупреждения подобных явлений принимают различные меры безопасности. Например, нефтепродукты подвергают гидроочистке- нагреванию на катализаторе в присутствии водорода; на заводах по переработке серы герметизируют аппаратуру и оборудуют их (заводы) специальными устройствами для улавливания из отходящих газов вредных веществ. Непременным условием работы каждого завода является наличие очистных сооружений, в которых отходы производства разрушаются микроорганизмами. Одним из путей уменьшения загрязнения окружающей среды является также переход к использованию в качестве источников энергии (вместо нефтепродуктов) энергии Солнца, ветра, морских приливов и отливов и т. п.
Вопрос 2. Взаимное влияние атомов в молекулах на примере этанола и фенола.
План ответа на вопрос
1. Теория А.М. Бутлерова о взаимном влиянии атомов в молекуле
2. Взаимное влияние атомов в молекуле этанола
3. Взаимное влияние атомов в молекуле фенола
А.М. Бутлеров в теории химического строения органических веществ говорит, что свойства веществ зависят не только от количества атомов в молекуле, но и от их взаимного влияния друг на друга. Атомы в молекулах имеют разную относительную электроотрицательность. Эта характеристика атомов отражает их способность к притягиванию электронов. В результате происходит смещение пар электронов от одного атома к другому. Например, в молекуле этилового спирта
Н Н Н Н
×× ×× ×× ½ ½
Н: С: С: О: Н Н – С – С ® О Н
×× ×× ×× ½ ½
Н Н Н Н
Общие электронные пары углерода и кислорода и кислорода и водорода смещены к кислороду, т.к. его относительная электроотрицательность выше. А, следовательно, связи С–О и О-Н становятся более полярными и их реакционная способность возрастает.
В молекуле фенола
б-
CH CH
б- ×× б+
HC - О – H
б-
CH CH
Неподелённая электронная пара атома кислорода взаимодействует с π-электронным облаком бензольного ядра. В результате электронная плотность связи О-Н в большой степени смещена к кислороду и связь становится более полярной и атом водорода в гидроксогруппе легче отщепляется.
Атомы водорода в бензольном ядре фенола также более подвижны. Неподеленная электронная пара кислорода взаимодействует с электронами бензольного ядра. В результате возникает электронная плотность в положениях 2, 4, 6 бензольного ядра. В результате атомы водорода в положениях 2, 4, 6 становятся более подвижными и легко отщепляются.
Вопрос 3. Провести реакции, подтверждающие качественный состав серной кислоты.
В состав H2SO4 входят ионы водорода и сульфатионы.
H2SO4 ® 2Н+ + SO42-
Наличие ионов Н+ доказывает с помощью лакмуса. В пробирку наливаем 1 мл. H2SO4 и добавляем 1-2 капли лакмуса – раствор окрашивается в красный цвет. Наличие SO42-доказываем с помощью BaCl2:
В пробирку наливаем 1-2 капли H2SO4 и добавляем несколько капель BaCl2. Выпадает белый осадок.
H2SO4 + BaCl2 ® BaSO4¯ + 2НCl
SO42- + Ba2+ ® BaSO4
Билет 23.
Вопрос 1. Примеры многообразия неорганических и органических веществ; взаимосвязь органических и неорганических веществ.
План ответа на вопрос.
1. Причины многообразия неорганических веществ
2. Причины многообразия органических веществ
3. Взаимосвязь органических и неорганических веществ
Неорганических веществ известно около 500 тысяч. Это многообразие связано, прежде всего, с тем, что в настоящее время известно 116 химических элементов, которые образуют простые вещества, а также оксиды, основания кислоты, соли, летучие водородные соединения, гидриды и др. сложные вещества.
Количество сложных веществ увеличивается, т.к. элементы могут иметь разные степени окисления, например
+1 +5 +7
HCl-, HClO, HClO3, HClO4
Для неорганических веществ характерно также явление аллотропии, например, углерод образует 4 аллотропных видоизменения: алмаз, графит, карбид, фуллерен; фосфор 3 аллотропных видоизменения: белый, черный и красный фосфор.
Еще больше известно органических веществ – около 8 млн. Атом углерода имеет небольшие размеры и достаточно высокую валентность (IV), его атомы способны соединяться между собой, образуя цепи, линейные, разветвленные и замкнутые. Углерод может образовывать вещества с одинарными, двойными и тройными связями. Для органических веществ характерно явление изомерии – т.е. существование веществ с одинаковой молекулярной формулой, но различным строением молекул. Эти различия в строении касаются расположения кратных связей и функциональных групп в молекулах, а также строении углеродных цепочек.
Взаимосвязь органических и неорганических веществ заключается в возможности их взаимопревращений, например:
O
CaCO3 ® CaO ® CaC2 ® C2H2 ® CH3 – C ® C2H5OH ® CO2
t H
CaCO3 ® CaO + CO2
CaO + 3C ® CaC2 + CO
CaC2 + H2O ® C2H2 + Ca(OH)2
Hg+ O
C2H2 + H2O ® CH3 – C
H
O
CH3 – C + H2 ® CH3CH2OH
H
CH3CH2OH + 3O2 ® 2CO2 + 3H2O
Эта возможность объясняется тем, что и органические и неорганические вещества образованы атомами, которые хотя и отличаются друг от друга, но все они имеют одинаковую физическую природу (ядро, состоящее из протонов и нейтронов и электроны, движущиеся вокруг ядра).
Вопрос 2. Получение спиртов из предельных и непредельных углеводородов. Промышленный синтез метанола.
1. Общие способы получения спиртов
а) получение одноатомных спиртов
- из предельных углеводородов
- из непредельных углеводородов
б) получение многоатомных спиртов
2. Промышленный синтез метанола.
а) одноатомные спирты можно получить:
- из предельных углеводородов через галогенпроизводные, например
СН4 + Cl2 ® CH3Cl + HCl
CH3Cl + KOH ® CH3OH + KCl
- гидротацией непредельных углеводородов, например
t H3РO4
H2C = CH2 + Н2О ® CH3CH2ОН
б) Многоатомные спирты можно получить окислением алкенов
КМn O4
H2C = CH2 + Н2О + [O] ® CH2 - OН
½
CH2 - ОН
Метанол называют древесным спиртом, т.к. раньше его получали при пиролизе древесины. В настоящее время в промышленности метанол получают из синтез – газа – смеси оксида углерода (II) и водорода. Синтез газ получают из метана
T=4000C
CH4 + Н2О ® CO + 3H2
пар kt
CO + 2H2 CH3ОН +Q
метанол
Реакция проводится при температуре 250-3000С, р = 10мпа, катализатор – смесь оксидов цинка, хрома, меди. Данная реакция обратима, а, следовательно, необходимо поддерживать условия, смещающие равновесие в сторону образования метанола: повышенное давление, постоянный отвод из системы образовавшегося метанола, обеспечение постоянной циркуляции исходных веществ. Все аппараты для производства метанола максимально герметичны. При производстве используется циклическая схема, что делает производство практически безотходным. Оборудование для производства метанола сходно с оборудованием для производства аммиака.
При ответе на вопрос рекомендуется воспользоваться таблицей «Производство аммиака»
Вопрос 3. На практике осуществить превращения: CuSO4 ® Cu(OH)2 ® CuO
В пробирку налить 1 мл раствора CuSO4 и добавить Cu(OH)2 до образования осадка.
CuSO4 + 2NaOH ® Cu(OH)2¯+ Na2SO4
Cu2+ + 2OH ® Cu(OH)2¯
Полученный осадок нагреть на пламени спиртовки до образования черного оксида меди.
Cu(OH)2 ® CuO + Н2О
Билет 24.
Вопрос 1. Высшие кислородсодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств.
План ответа на вопрос
1. Состав кислородсодержащих кислот третьего периода
2. Физические свойства
3. Химические свойства. Изменение окислительных свойств.
Химические элементы третьего периода образуют следующие кислородсодержащие кислоты:
+4 +5 +6 +7
H2 SiO3 H3 PO4 H2 SO4 H SO4
Кремниевая кислота – твердое вещество, не растворимое в воде. Ортофосфорная кислота – твердое вещество, хорошо растворимое в воде. Серные и хлорные кислоты - жидкости, хорошо растворимые в воде. Для кислородосодержащих кислот третьего периода характерны общие химические свойства кислот:
1. Все кислоты, кроме кремниевой являются электролитами и в водных растворах диссоциируют на ионы:
H3PO4 3H+ + PO43-
H2SO4 ® 2H+ + SO42-
HClO4 ® H+ + ClO42-
2. Взаимодействуют с металлами, стоящими в ряду напряжения металлов до водорода
H2SO4 + Zn ® ZnSO4 + H2
2H+ + Zn0 ® Zn2+ + H0
3. Взаимодействуют с оксидами металлов
H3PO4 +3CuO ® Cu3 (PO4)2 ¯ + 3H2O
4. Взаимодействуют с основаниями
HClO4 + KOH ® KClO4 + H2O
H+ + OH- ® H2O
5. Вытесняют менее активные кислоты из свойства солей:
H2SO4 + Na2CO3 ® Na2SO4 + H2O + CO2
2H+ + CO32- ® H2O + CO2
6. Изменяют окраску индикатора: синий лакмус в красный цвет.
Сила этих кислот возрастает от кремниевой к хлорной. Кремниевая – очень слабая кислота. Фосфорная – кислота средней силы. Серная и хлорная – сильные кислоты. Атомы неметаллов в этих кислотах находятся в высшей степени окисления, поэтому для них характерны окислительные свойства.
Самым сильным окислителем является серная кислота. Она может окислять металлы, стоящие в электрохимическом ряду после водорода:
Cu + 2H2SO4 ® CuSO4 + SO2 + 2H2O
Вопрос 2. Общая характеристика высокомолекулярных соединений: состав, строение реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
План ответа на вопрос.
1. Состав и строение полимеров на примере реакции получения полиэтилена.
2. Свойства полимеров
3. Получение на примере бутадиенового каучука и капрона
Полимеры – вещества, молекулы которых состоят из многократно повторяющихся структурных звеньев, соединенных между собой химическими связями.
t, kat структурное звено степень полимеризации
n H2C = CH2 ® (-CH2 - CH2 -) n
мономер макромолекула
Макромолекула – это молекула полимера
Мономер – вещество, из которого получают полимер
Структурное звено – многократно повторяющаяся группа атомов в молекуле полимера.
Степень полимеризации (n) – показывает, сколько структурных звеньев входит в состав молекулы полимера.
Полимеры могут иметь разную геометрическую структуру:
1. Линейную (целлюлоза)
2. Разветвленную (крахмал)
3. Пространственную (резина)
Полимеры могут иметь регулярное и нерегулярное строение. Например, полипропилен может иметь нерегулярную структуру:
СH3 СH3
½ ½
- СH2 – CH - CH2 – CH – CH2 – CH - CH2 – CH -
½ ½
СH3 СH3
И регулярную структуру
СH3 СH3
½ ½
- CH - СH2 – CH - CH2 – CH – CH2 – CH -
½ ½
СH3 СH3
Регулярность строения оказывает влияние на эластичность полимера. Полимеры могут быть термопластичными термореактивными.
- термопластичность – свойство полимера плавиться при нагревании и сохранять свою форму при охлаждении.
- Термореактивность – свойство полимера не плавиться при нагревании. Также полимеры выдерживают высокую температуру, но при перегреве разрушаются.
К термопластичным относятся: полиэтилен, полипропилен, капрон и др. пластмассы. К термореактивным относятся фенолформальдегидные смолы, полимеры природного происхождения: целлюлоза, белок и др.
Полимеры – вещества химически инертные, они не взаимодействуют с основаниями и кислотами, кроме азотной.
Способы получения
1. Реакция полимеризации – получение высокомолекулярного вещества из низкомолекулярного
n СH2 = CH – CH = CH2 ® (– CH2 – CH = CH - CH2 –) n
бутадиен – 1, 3 бутадиеновый каучук
2. Реакция поликонденсации - получение высокомолекулярного вещества из низкомолекулярного, идущее с отщеплением побочного низкомолекулярного продукта.
Например, получение капрона из аминокапроновой кислоты.
H O
T, kat ½ ½½
n H2N – (СH2)5 – COOH ® - N – (СH2)5 – C - n + n H2O
ламинолакроновая капрон
кислота
Вопрос 3. Определить массу оксида хрома, вступившего в реакцию с алюминием, необходимого для получения 184г. хрома, что составляет 88% от теоретически возможного.
| Дано: m (Cr)kp = 184г. W% (вых. Cr)=88% | Решение: х 4 моль |
| m (Cr2O3) -? | Cr2O3 + 2Al ® Al2O3 + 2Cr
1 моль 2 моль
W% (вых.) = 

 г г
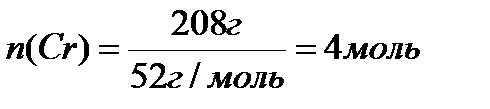 Соотношение веществ в уравнении реакции 1:2, следовательно:
Х=2моль
m (Cr2O3) = 2 моль × 152г/моль = 304г.
Соотношение веществ в уравнении реакции 1:2, следовательно:
Х=2моль
m (Cr2O3) = 2 моль × 152г/моль = 304г.
|
Билет 25.
Вопрос 1. Общие способы получения металлов. Практическое значение электролиза на примере солей без кислородных кислот.
План ответа на вопрос
1. Понятие металлургии
2. Пирометаллургия
3. Гидрометаллургия
4. Электрометаллургия
5. Электролиз солей без кислородных кислот. Его практическое применение
Металлургия – это наука о промышленных способах получения металлов из руд.
Рудами называют минералы и их соединения, из которых выделение чистых металлов технически возможно и экономически выгодно. Любой металлургический процесс – это процесс восстановления металла
Me+n + n ē ® Me0
Существуют следующие способы получения металлов:
- пирометаллугрия – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов (алюминия, магния), например:
t
Cu2O + C ® 2Cu +CO
t
MoO3 + 2H2 ® Mo + 3 H2O
t
FeO + CO ® Fe + CO2
t
3 MnO2 + 4Al ® 2Al2O3 + 3Mn
- гидрометаллургия – это восстановлениеметаллов из их солей в растворе. Процесс происходит в два этапа:
1. Природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла;
2. Из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом, например:
СuO + H2SO4 ® CuSO4 + H2O
CuSO4 + Fe ® FeSO4 + Cu
- электрометаллургия – восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита.
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направлено: катионы к катоду (отрицательно заряженному электроду), анионы – к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются, например:
| NaCl ® Na+ + Cl- | ||
| K(-) Na+ Na+ + ē ® Na0 | Cl- ® A (+) 2Cl- - 2ē ® Cl2o | |
| Na+ + ē 2Cl- - 2ē ® Cl2o | 2 1 | |
| 2Na ® 2Na0 + Cl2o | ||
На катоде образуется металлический натрий, на аноде – хлор. Электролиз расплавов и растворов веществ широко применяется в промышленности:
1. Для получения металлов (алюминий, магний, натрий, кадмий)
2. Для получения водорода, галогенов, щелочей.
3. Для очистки (рафинирования) металлов.
4. Для нанесения защитных покрытий (хрома, никеля, кадмия и др.)
5. Для получения металлических копий
Вопрос 2. Виды синтетических каучуков, их свойства и применение.
План ответа на вопрос
1. Понятие каучуков, их общие свойства.
2. Получение каучука С.В. Лебедевым
3. Виды синтетических каучуков и их применение.
Каучуки – эластичные материалы, из которых получают резину. Каучуки хорошие диэлектрики, водо- и газонепроницаемы, но имеют низкую температуру плавления и высокую температуру замерзания. Каучуки бывают натуральные и синтетические. Натуральный каучук получают коагуляцией млечного сока дерева Гевея, которое произрастает в Бразилии и Юго-Восточной Азии. Мономером натурального каучука является 2-метилбутадиен-1,3. К началу ХХ века очень остро встала проблема получения синтетического каучука. В 1932 г. русский ученый академик С.В. Лебедев разработал промышленный способ получения бутадиенового каучука из диеновых углеводородов.
Сначала был получен бутадиен-1,3 из этилового спирта:
t, kat
2C2H5OH ® CH2 =CH – CH = CH2 +2 H2O + H2
бутадиен-1,3
Затем бутадиен-1,3 подвергают полимеризации:
t, kat
nCH2 = CH - CH = CH2 ® (- CH2 – CH = CH - CH2 -)n
Обладая хорошими качествами, он все-таки уступал по эластичности каучуку природному. Дело в том, что природный каучук обладает пространственно регулярным строением: его изопреновые звенья соединены друг с другом, образуя цис-структуру, в которой группы СН2 расположены по одну сторону от линии двойной связи.

В середине XX века, когда были найдены необходимые катализаторы, был синтезирован аналог природного каучука — изопреновый каучук, а спустя несколько лет в нашей стране был получен дивиниловый каучук регулярного строения, превосходящий природный каучук по эластичности:

Такая же цис-структура придает макромолекулам каучука исключительную гибкость, что является необходимым условием развития высоко-эластических свойств.
В последующие годы были созданы синтетические каучуки, имеющие разные специфические свойства:

| хлоропреновый каучук (высокая термо- и маслостойкость) | фторкаучук (высокая термическая и химическая стойкость) |
Путем совместной полимеризации 1,3-бутадиена и стирола (винилбензола) был получен каучук с высокими механическими свойствами (ударопрочность) — бутадиенстирольный каучук:

Наличие в каждом звене каучука двойной химической связи открывает возможность получения резины различного качества.
Резины получают вулканизацией каучуков при 1° = 130-140°С, предварительно смешав их с определенным количеством серы. Ее атомы связывают вместе множество молекул каучука (по местам разрыва двойных связей), образуя пространственно «сшитую» структуру.
В настоящее время более половины всей резины производится из синтетических каучуков.
Каучук и резина занимают особое место среди современных материалов. Они очень широко используются в различных отраслях промышленности (автомобильные шины, уплотнительные материалы, трубы и др.) и в быту (резиновая обувь, игрушки и др.).
Вопрос 3. Получить углекислый газ и провести реакции, подтверждающую его свойства.
Прибор для получения газов закрепить в лапке штатива. Поместить в него несколько кусочков мрамора и прилить соляную кислоту
CaCO3 + 2HCl ® CaCl2 + H2O + CO2
CaCO3 + 2H+ ® Ca2+ + H2O + CO2
Газоотводную трубку опустить в пробирку с известкой водой, через некоторое время известковая вода мутнеет:
Ca(OH)2 + CO2 ® CaCO3¯ + H2O
Затем газоотводную трубку опустить в пробирку с водой, подкрашенной лакмусом. Через некоторое время окраска раствора изменится с синего на красноватую. Следовательно образуется угольная кислота:
H2O + CO2 H2 СO3
Литература
 2020-06-29
2020-06-29 209
209







