Введение
Согласно материалам, рекомендованным Министерством образования Российской Федерации для организации и проведения итоговой аттестации выпускников 11-х классов общеобразовательных учреждений, выпускные экзамены по химии могут проводиться по-разному: устный экзамен по билетам, защита рефератов, выполнение тестовых заданий.
В Профессиональном лицее итоговую аттестацию учащихся, получающих среднее образование, целесообразно проводить в виде устного экзамена по билетам.
При подготовке к экзамену учащимся необходимо повторить материал, который они изучали в течение четырех лет (два года в школе и два года в лицее). Большинство учащихся по окончании основной школы имеют крайне низкий уровень подготовки по предмету. Обучение химии в лицее проходит крайне сложно: многочисленные пробелы в знаниях лишают учащихся возможности успешно усваивать новый материал по изучаемым тема программы. Поэтому при подготовке к экзамену, даже при наличии современных пособий и учебников, при использовании конспектов уроков далеко не все учащиеся оказываются способными логически изложить изученный материал. Особые трудности вызывает использование специальных терминов, составление уравнений химических реакций, решение расчетных задач.
Данная методическая разработка включает в себя примерные развернутые ответы на все вопросы экзаменационных билетов. Содержание ответов на билеты соответствует требованиям к усвоению учащимися обязательного образовательного минимума по химии и материалам современных школьных учебников.
Каждый билет включает в себя три вопроса: вопрос из курса неорганической химии, вопрос по органической химии и практическое задание или расчетную задачу.
В ходе итоговой аттестации при ответе на вопросы билетов по неорганической химии учащийся должен опираться на знание атомно-молекулярного учения, Периодического закона и Периодической системы Д.И. Менделеева, теории электролитической диссоциации, закона сохранения массы веществ и других важнейших правил и законов химии.
Вопросы по органической химии требуется освящать на основе знания теорий химического строения органических веществ А.М. Бутлерова. При характеристике тех или иных органических соединений следует раскрывать зависимость свойств веществ от их строения.
Выполняя практические задания учащиеся должны показать не только теоретические знания, но и практические умения и навыки работы с лабораторным оборудованием. При решении задач должны уметь произвести расчеты по химическим уравнениям или по нахождению формулы вещества.
При ответе на вопросы билета следует обращать внимание на правильное написание химических формул веществ, умении верно называть химические вещества, не допускать ошибок в использовании химической терминологии.
Данная методическая разработка, написанная доступным, понятным языком, содержащая материал непосредственно прорабатывавшийся на уроках химии в лицее, поможет учащимся качественно подготовиться к итоговой аттестации и успешно сдать выпускные экзамены за курс полной средней школы.
Билет 1
Вопрос 1. Периодический закон и периодическая система Д.И. Менделеева на основе представлений о строении атома. Значение периодического закона для развития науки.
План ответа на вопрос
- Предпосылки создания закона.
- Открытие закона Д.И. Менделеевым.
- Современная формулировка и физический смысл закона.
- Периодическая система
- Значение закона для развития науки.
К 60-м годам XIX века было известно 63 химических элемента и описаны свойства многочисленных образованных ими соединений, но не существовало единого закона, который мог бы связать свойства простых веществ и их соединений с какой-либо характеристикой атома.
Многие ученые пытались классифицировать химические элементы. Шведский химик И.Я. Берцелиус разделил все элементы на металлы и неметаллы на основе различий в свойствах простых веществ и образованных ими соединений. Он определил, что металлам соответствуют основные оксиды и основания, а неметаллам кислотные оксиды и кислоты. Но в данной классификации им не учитывались амфотерные элементы и их соединения.
Немецкий химик И.В. Деберейнер разделил элементы по три на основе сходств в свойствах, образуемых ими веществ и так, чтобы атомная масса среднего элемента была равна среднему арифметическому двух крайних. Например, Li, Na, K. Но ему удалось составить лишь четыре триады, классифицировать все остальные элементы он не сумел.
Классифицировать элементы пытались и другие ученые, но ни одна из попыток не привела к созданию системы, отражающей взаимосвязь элементов и выявляющей природу их сходства и различий.
В 1860 году на международном съезде в немецком городе Карсруэ были окончательно утверждены понятия атома, молекулы, а также атомного веса. Именно это понятие, как неизменную характеристику атома, взял за основу Д.И. Менделеев. Он расположил элементы в порядке возрастания атомного веса. В результате он составил естественные группы сходных по свойствам элементов, которые объединил в единую систему. При этом он обнаружил, что свойства элементов изменяются периодически, т.е. через определенное число элементов встречаются сходные по свойствам.
Днем рождения закона считаем 1 марта 1869 года.
Современная формулировка закона учитывает то, что не мог знать Д.И. Менделеев, а именно, строение атома.
Впервые физический смысл порядкового номера раскрыл голландец Ван-Дер-Брук, который теоретически доказал, что порядковый номер химического элемента равен заряду ядра его атома. Современная формулировка закона звучит так:
| Свойства элементов и образованных ими соединений находятся в периодической зависимости от зарядов ядер атомов элементов |
Физический смысл закона:
1. Свойства элементов изменяются с изменением заряда ядра;
2. Свойства изменяются периодически, т.к. периодически повторяются элементы, имеющие одинаковое строение внешнего энергетического уровня.
Периодическая система химических элементов состоит из семи периодов (трех малых и четырех больших) и 8 групп.
Период – это горизонтальный ряд элементов, расположенных в порядке возрастания заряда ядра, начинающийся щелочным металлом и заканчивающийся благородным газом.
В пределах периода с возрастанием заряда ядра металлические свойства элементов убывают, а неметаллические – усиливаются, т.к. возрастает количество электронов на внешнем энергетическом уровне.
Номер периода численно равен количеству энергетических уровней атома элемента.
Группы – это вертикальный ряд элементов, расположенных в порядке возрастания атомных масс.
Группа делится на две подгруппы: главную и побочную.
В главную подгруппу входят элементы и малых и больших периодов.
В побочную – только элементы больших периодов. В пределах главных подгрупп сверху вниз неметаллические свойства элементов убывают, а металлические усиливаются, т.к. возрастает радиус атома элемента. Номер группы численно равен количеству элементов на внешнем энергетическом уровне элементов главных подгрупп.
Значение периодического закона
- с помощью периодического закона ученые систематизировали и обобщили все сведения о химических элементах и образуемых ими соединений;
- с помощью периодического закона были уточнены атомные массы и валентности некоторых элементов;
- с открытием появилась возможность предсказывать свойства еще не открытых элементов;
- периодический закон подтвердил наиболее общие законы развития природы, открыл путь к познанию строения атома.
Вопрос 2. Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение метана.
План ответа на вопрос
1. Дать понятие предельных углеводородов; алканы, циклоалканы, их общая формула.
2. Гомологический ряд, строение гомологов данного ряда на примере метана и атома.
3. Физические свойства гомологов.
4. Химические свойства алканов на примере метана.
5. Применение метана.
Предельные углеводороды – это органические вещества, в молекулах которых каждая валентность углерода до предела насыщена водородом.
Предельные углеводороды могут быть двух видов: алканы с общей формулой СnH2n+2 и циклоалканы с общей формулой СnH2n
Метан образует гомологический ряд:
| CH4 | C2H6 | C3H8 | C4H10 | C5H12 | C6H14 | и др. |
| Метан | Этан | Пропан | Бутан | Пантан | Гексан |
В молекулах предельных углеводородов атомы углерода образуют только s - связи. Рассмотрим строение молекулы метана:
| Н Н С Н Н |
Атом углерода в молекуле метана находится в состоянии Sp3 – гибридизации. При этом валентные углы равны 109028’, поэтому молекулы метана представляют собой воображаемый тетраэдр, в центре которого находится атом углерода, а в вершинах атомы водорода.
Начиная с этана углеродная цепь начинает удлиняться. Одинарная связь С-С имеет длину 0,154 нм. Углеродная цепочка может быть линейной или иметь разветвленное строение.
Физические свойства
В гомологическом ряду с возрастанием молекулярной массы увеличивается плотность, а также температура плавления и кипения веществ. Низкие аланы (С5Н14 – С15Н32) жидкости, высшие аланы твердые вещества.
Химические свойства
1. Аланы горят: CH4 + 2O2 ® CO2+2H2O
2. Вступают в реакции замещения:
CH4 + Cl2 ® CH3Cl + HC1
Реакция может продолжаться до полного замещения всех атомов водорода
3. При высокой температуре атомы вступают в реакции
а) разложения t>10000C
CH4 ® C +2H2
б) отщеплением t=15000C
2CH4 ® C2H2 +3H2
Применение
Метан используется в качестве топлива, т.к. при его горении выделяется большое количество энергии. А также он является ценным сырьем для органического синтеза.
Вопрос 3. Определите массу соли, которая образуется при взаимодействии оксида меди с 2 моль соляной кислоты.
| Дано n(HCl)=2 моль | Решение 2 моль x CuO + 2HCl ® CuCl2 + H2 2 моль 2 моль Из 2 моль HCl = образуется 2 моль CuCl2
Из 2 моль HCl = образуется х моль CuCl2
Х=1 моль M=n× m M (CuCl2) = 1 моль × 135г/моль = 135 i1
Ответ: m (соли) = 135 г
|
| m (соли)-? |
Билет 2
Вопрос 1. Строение атомов и закономерности в изменениях свойств химических элементов на примере:
а) элементов одного периода
б) одной группы главной подгруппы
План ответа на вопрос
1. Гипотеза Дж. Томсона
2. Планетарная модель Э. Резерфорда
3. Квантовые постулаты Н. Бора
4. Состояние электрона в атоме
5. Изменения свойств элементов на примере одного периода
6. Изменения свойств элементов на примере одной группы главной подгруппы
Слово «атом» переводится с греческого как неделимый и пришло к нам из глубокой древности. Исследования ученых, сделанные в конце XIX века начале ХХ веков, показали, что предположения о неделимости атома ошибочны. Ученые пришли к выводу, что атом обладает собственной структурой и имеет сложное строение.
В 1904 году Дж. Томсон в своей работе «О структуре атома» дал описание своей модели, получившей название «сливового пудинга». В этой модели атом уподоблен сферической капле с положительным зарядом. Внутри которой вкраплены отрицательно заряженные электроны. Электроны совершают колебательные движения, благодаря которым атом излучает или поглощает энергию. Атом в целом нейтрален. Модель Томсона не была подтверждена экспериментальными проектами и осталась гипотезой.
В 1911 году Э. Резерфорд предложил планомерную модель атома, согласно которой атом состоит из положительно заряженного ядра и отрицательно заряженных электронов вращающихся вокруг ядра по замкнутым орбитам подобно тому, как планеты вращаются вокруг солнца.
Классическая модель Резерфорда не могла объяснить излучение и поглощение энергии атомом.
В 1913 году Н. Бор внес в модель Резерфорда квантовые представления, которые изложил в виде постулатов:
Первый постулат. Электрон вращается вокруг ядра по строго определенным замкнутым орбитам в соответствии с «разрешенными» значениями энергии Е1, Е2, Е3, … Еn, при этом энергия не поглощается и не излучается.
Второй постулат. Электрон переходит из одного «разрешенного» энергетического состояния в другое, что сопровождается поглощением или излучением энергии.
В 1932 году была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов ( и нейтронов (
и нейтронов (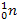 ). Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется электронной орбиталью.
). Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется электронной орбиталью.
Состояние электрона в атоме описывается с помощью квантовых чисел. Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно численно равно номеру периода, в котором располагается элемент в периодической системе Д.И. Менделеева.
Главное квантовое число характеризует энергию электронов, занимающих энергетический уровень. Наименьшей энергией обладают электроны первого уровня, наиболее близкого к ядру. Электроны следующих уровней будут характеризоваться большим запасом энергии.
С помощью главного квантового числа можно рассчитать количество электронов на энергетическом уровне по формуле:
N=2n2, где N – максимальное количество электронов.
Главное квантовое число также показывает количество подуровней на энергетическом уровне. Следовательно:
На первом энергетическом уровне - 2ẽ на 1s- подуровне
На втором энергетическом уровне - 8ẽ S2р6
На третьем энергетическом уровне - 18ẽ S2р6 Cl10
На четвертом энергетическом уровне - 32ẽ S2р6 d10f14
Рассмотрим строение атомов элементов III периода:
 ẽ 1S22S22p6 3S1 (самый активный металл III-го периода)
ẽ 1S22S22p6 3S1 (самый активный металл III-го периода)
 ẽ 1S22S22p6 3S23p1 (амфотерный элемент)
ẽ 1S22S22p6 3S23p1 (амфотерный элемент)
 ẽ 1S22S22p6 3S23p3 (неметалл)
ẽ 1S22S22p6 3S23p3 (неметалл)
 ẽ 1S22S22p6 3S23p5 (самый активный неметалл III-го периода)
ẽ 1S22S22p6 3S23p5 (самый активный неметалл III-го периода)
В пределах периода с возрастанием заряда ядра металлические свойства убывают, а неметаллические усиливаются, т.к. возрастает количество электронов на внешнем энергетическом уровне. Рассмотрим изменение свойств атомов электронов в пределах III группы главной подгруппы.
 ẽ 1S2 2S22p1
ẽ 1S2 2S22p1
 ẽ 1S22S22p6 3S23p1
ẽ 1S22S22p6 3S23p1
 ẽ … 4 S24p1
ẽ … 4 S24p1
В пределах группы с возрастанием заряда ядра металлические свойства усиливаются, а не металлические убывают, т.к. увеличивается количество энергетических уровней, т.е. возрастает радиус атома.
Вопрос 2. Непредельные углеводороды ряда этилена, общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена.
План ответа на вопрос.
1. Дать понятие алкенов. Их общая формула.
2. Гомологический ряд этилена. Строение гомологов на примере этилена.
3. Физические свойства гомологов
4. Химические свойства алкенов на примере этилена.
5. Применение этилена.
Алкены – это непредельный углероды, в молекулах которых имеется одна двойная связь.
Общая формула алкенов CnH2n. Этилен образует гомологический ряд
H2C = CH2, CH3 – CH = CH2, CH3 – CH = CH – CH3 и т.д.
Этилен пропен бутен
В молекуле этилена и его гомологов атомы углерода, образующие двойную связь, находятся в состоянии Sp2 - гибридизации, следовательно, у них имеются три гибридные орбитали, которые располагаются в пространстве под углом 1200 друг к другу.
s-связь образуется при перекрывании гибридных орбиталей соседних атомов углерода.
Оставшиеся негибридными р – орбитали располагаются перпендикулярно линии молекулы и перекрываясь над и под плоскостью образуют π - связь. Длина двойной связи 0,134 нм.
Та часть молекулы, которая содержит двойную связь имеет плоское строение. Двойная связь жесткая связь, а следовательно невозможно вращение вокруг нее отдельных частей молекул. Это ведет к образованию пространственных изомеров.
H H H CH3
\ / \ /
C = C C = C
/ \ / \
CH3 CH3 CH3 H
Цис – бутен – 2 транс – бутен 2
Физические свойства
В гомологическом ряду с возрастанием молекулярной массы увеличивается плотность, а также температура плавления и кипения веществ.
Химические свойства
Химические свойства алкенов обусловлены наличием в их молекулах двойной связи. Двойная связь содержит слабую π – связь, которая легко разрывается в химических реакциях.
1. Реакция присоединения:
| t,kat |
H2C=CH2+H2 → H3C – CH3
- галогенов
H2C=CH2+H2 → H2С – СH2
│ │
Cl Cl
- галогенводородов
H2C=CH2+HСl → H3С – СH2
│
Cl
- воды
H2C=CH2+ОH → CH3СH2 OH
2. Реакция горения
C2H4+3O2 → 2CO2+2H2O
3.
| KМnO4 |
H2C=CH2+H2O+[O] → CH2 - CH2
│ │
OH OH
Этиленгликоль
Обесцвечивание раствора перманганата калия является качественной реакцией на двойную связь.
4. Реакция полимеризации
| t,kat |
n H2C = CH2 → (-H2C – CH2-)n
Этилен используется для производства этанола, этиленгликоля, дихлорэтана, пластмасс, а также других органических веществ.
Вопрос 3. Выданы пробирки с растворами соляной кислоты гидроксида натрия, сульфата натрия. Определите выданные вещества с помощью характерных реакций.
1. Разделить выданные растворы на 2 части.
2. Добавить в 3 пробирки с веществами по 1-2 капли синего лакмуса (3 пробирка остаётся в качестве контрольной). Образование красной окраски указывает на присутствие кислоты. Синей – щелочи. Фиолетовой – соли.
3. Подтвердим наличие щелочи и соли. Разделим оставшуюся в пробирках щелочь и соль на 2 части. По одной пробирке со щелочью и солью оставим в качестве контрольных. В другие пробирки добавим фенолфталеин. Наличие малиновой окраски говорит о наличии щелочи.
4. Докажем наличие в пробирке сульфата натрия. Добавим в оставшуюся пробирку раствор хлорида бария. Белый осадок говорит о наличии соли Na2SO4
Na2SO4+BaCl2 → 2NaCl +BaSO4 ↓
Ba2+ + SO42- → BaSO4
Билет 3
Вопрос 1. Виды химических связей: ионная, металлическая ковалентная (полярная и неполярная); водородная; простые и кратные связи в молекулах органических веществ.
План ответа на вопрос
1. Общее понятие химической связи.
2. Ковалентная связь
- механизм образования (обменный и донорно-акценторный)
- неполярная ков. связь
- полярная ков. связь
- простые и кратные связи
3. Ионная связь
4. Металлическая связь
5. Водородная связь
Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы иона, радикалы и кристаллы.
Ковалентная связь – это связь, возникающая между атомами за счет образования общих электронных пар. Она может образовываться по обменному и донорно – акценторному механизму.
Обменный механизм – действует, если атомы образуют электронные пары за счет не спаренных электронов.
Например:
1. Н2 – водород
| ↑ |
+1Н 1S1 H∙ + ∙H → H(:)H или H-H
связь образуется благодаря образованию общей электронной пары при перекрывании s – орбиталей.
+ →
S S S - S
Донорно-акценторный механизм
Рассмотрим на примере образования хлорида аммония.
H H +
| : |
H – N: + H+Cl- → H – N Cl-
H H
Ион аммония
Донор (азот) имеет электронную пару, акцентор (водород) свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные. Три образуются по обменному механизму и одна по донорно-акценторному. Все четыре связи N-H в катионе аммония равноценны.
По степени смещения электронной пары к одному из связанных ею атомов ковалентная связь может быть полярной и неполярной.
- ковалентная неполярная связь – образуется между атомами электроотрицательности которых равны, например: H2 O2 Cl2 и т.д.
- ковалентная полярная связь – образуется между атомами электроотрицательности которых отличаются, но не сильно, например: HCl HF H2O и т.д.
По способу перекрывания электронных орбиталей различают σ - и π - связи
σ – связь – это связь, которая образуется на линии, соединяющей центры атомов.
σ σ σ
S – S S - P P - P
π - связь – это связь, которая образуется при боковом перекрывании р – орбит.
π
Р - Р
Ионная связь возникает между атомами элементов, резко отличающихся по электроотрицательности (типичные металлы с типичными неметаллами). Стремясь приобрести устойчивую электронную конфигурацию, атомы металлов отдают электроны, превращаясь в положительно заряженные ионы, а атомы неметаллов принимают их, превращаясь в отрицательные ионы. Разноименно заряженные ионы притягиваются, образуя химическое соединение.
Na+ + F- ® NaF
Химическая связь между ионами за счет электростатического притяжения называется ионной.
Связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов, называется металлической. Она характерна для металлов и их сплавов. Природа этой связи также электростатическая: атомы металлов легко отдают валентные электроны и превращаются в положительные ионы. Свободные электроны, оторвавшиеся от атомов, перемещаются так, что взаимодействуют с ядрами двух атомов и более. Так возникает металлическая связь, существованием её объясняются общие свойства металлов.
Связь, которая образуется между молекулами, в состав которых входят водород и сильно электроотрицательный элемент F, О, N, реже S, C1 называется водородной. Водород в таких молекулах находится в виде протона и может взаимодействовать с неподеленной электронной парой другого атома или иона, обобществляя ее. Водородная связь очень слабая, обозначается точками.
Водородная связь оказывает влияние на свойства многих веществ. Особенно распространена она в молекулах белков, нуклеиновых кислот, а потому играет важную роль в процессах жизнедеятельности.
Вопрос 2. Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.
План ответа на вопрос.
1. Дать понятие циклоалканов. Их общая формула. Гомологический ряд.
2. Строение молекул циклоалканов.
3. Химические свойства.
4. Нахождение в природе и практическое значение.
Циклоалканы – это предельные углеводороды циклического строения.
Их общая формулаCnH2n
| H2C |
| CH2 |
| H2C |
| CH2 |
| CH2 |
| CH2 |
| CH2 |
| H2C |
| H2C |
| CH2 |
| CH2 |
| CH2 |
| H2C |
| CH2 |
| CH2 |
| H2C |
| CH2 |
| CH2 |
Циклопропан Цикклобутан Циклопентан Циклогексан
Все атомы углерода в молекулах циклопропана находятся в состоянии SP3 - гибридизации, т.е. валентные углы в молекулах должны быть равны 109028’. Но это справедливо не во всех ситуациях.
В молекуле циклопропана валентные углы равны 600, циклобутана - 900. В молекулах этих веществ имеется угловое напряжение, которое приводит к малой устойчивости циклов, и отражается на химических свойствах этих веществ.
Циклоалконы с большими размерами цикла образуют не жесткие молекулы, т.к. угловые напряжения в них отсутствуют.
Химические свойства.
1. Неустойчивость малых циклов обуславливает возможность реакций присоединения.
- водорода (гидрирование)
| CH2 |
t,Pt
+ Н2 ® СН3 - СН2 – СН3
| CH2 |
| H2C |
циклопропан пропан
- галогенов (галогенирование)
| CH2 |
| H2C |
| H2C |
| CH2 |
| |
Cl Cl
Циклобутан 1,4 - дихлорбутан
2. Для циклоалканов, имеющих в молекуле пять и более атомов, характерны реакции замещения:
| CH2 |
| CH2 |
| H2C |
| H2C |
| H2C |
| CH-Cl |
| CH2 |
| H2C |
| CH2 |
| CH2 |
| CH2 |
| H2C |
Циклопарофины главным образом находятся в составе нефти. Практическое значение имеют циклогексан и метилциклогексан, из которых получают бензол и толуол, широко используемые для получения красителей и медикаментов. Циклопропан используют для наркоза.
Вопрос 3. Определите массу гидроксида натрия, вступившего в реакцию с серной кислотой, если в результате образовалось 4 моль H2O.
| Дано: n(NaOH= 4моль | Решение |
| m(NaOH) -? | X 4 моль 2 NaOH + H2SO4 ® Na2SO4 + H2O 2 моль 1 моль Из 2 моль NaOH – 1 моль 2O Из х моль NaOH – 4 моль 2O Следовательно Х = 8 моль m = n*m m (NaOH) = 8 моль* 40 г/моль ® 320 г Ответ: m (NaOH) = 320 г. |
Билет 4
Вопрос 1. Классификация химических реакций в органической и неорганической химии.
План ответа на вопрос
1. Понятие химической реакции
2. Признаки химических реакций
- по числу и составу реагирующих веществ;
- по признаку изменения степени окисления;
- по признаку выделения или поглощения теплоты;
- по признаку обратимости.
Химические реакции – это процессы, в результате которых из одних веществ образуются другие, отличающиеся по составу и (или) строению.
I. По числу и составу реагирующих веществ
1. Реакции соединения – это реакции, при которых из нескольких простых или сложных веществ образуется одно более сложное.
S + O2 ® SO2
H2C = CH + Cl2 ® H2C – CH2
| |
Cl Cl
2. Реакции разложения – это химические реакции, при которых из одного сложного образуется два или несколько простых или сложных.
t
CaCO3 ® CaO + CO2
t>1000
CH4 ® C + 2H2
3. Реакции замещения – это реакции, между простыми и сложными веществами, при которых атомы простого вещества замещают один из элементов в сложном веществе.
CuSO4 + Fe ® FeSO4 + Cu
CH4 + Cl2 ® CH3Cl + HCl
4. Реакции обмена – это реакции между двумя сложными веществами, при которых вещества обмениваются своими составными частями.
NaOH + HCl ® NaCl + H2O
CH3COOH + NaOH ® CH3COONa +H2O
II. По признаку изменения степени окисления
1. Окислительно – восстановительные – идут с изменением степени окисления элементов
Mg0 + H2+SO4 ® Mg+2SO4 + H20
0 0
CH3-C+1 + Ag2O ® CH3C+3 + 2Ag0
H OH
2. Идущие без изменения степени окисления
CuO + H2SO4 ® CuSO4 + H2O
CH3COOH + CH3OH ® CH3COOCH3 + H2O
III. По признаку выделения или поглощения теплоты
1. Экзотермические – идущие с выделением тепла.
4P + 5O2 ® 2P2O5 + Q
CH4 + 2O2 ® CO2 + 2H2O + Q
2. Эндотермические – идущие с поглощением тепла
t
CaCO3 ® CaO + CO2 – Q
t
CH4 ® C + 2H2O – Q
IV. По признаку обратимости
1. Обратимые – идущие одновременно в двух взаимно противоположных направлениях
N2 + 3H2 2NH3
CH3COOH + CH3OH CH3COOCH3 + H2O
2. Необратимые – идущие до конца
Ba(OH)2 + 2HCl ® BaCl2 + 2H2O
2CH3OH + 2Na ® 2CH3ONa + H2
Вопрос 2. Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение.
План ответа на вопрос
1. Понятие диеновых углеводородов. Их общая формула.
2. Классификация диеновых углеводородов.
3. Строение и химические свойства алкадиенов.
4. Получение и применение алкадиенов.
Алкадиены – это непредельные углеводороды, в молекулах которых имеются две двойные связи.
Их общая формула CnH2n-2
В зависимости от взаимного положения двойных связей различают три вида диенов:
- алкадиены с кумулированными связями
H2C = C = CH2 пропадиен -1,3
- алкадиены с сопряженными связями
CH2 = CH – CH = CH2 бутадиен -1,4
- алкадиены с изолированными связями
CH2 = CH – CH2 – СH= CH2 пентадиен -1,4
Определяющее значение имеет положение двух двойных связей в молекуле алкадиена. Если эти двойные связи разделены между собой двумя или более одинарными s - связями (например, пентадиен -1,3), то такой алкадиен проявляет химические свойства аналогичные алкенам. Он способен к реакциям присоединения, в ходе которых эти двойные связи последовательно раскрываются (исчезает p - связь) с присоединением по месту раскрытия тех или иных атомов.
CH2 = CH – CH2 – CH = CH2 + Br2 ® CH2 = CH – CH2 – CH – CH2
| |
Br Br
CH2 = CH – CH2 – CH – CH2 + Br2 ® CH2 - CH – CH2 – CH – CH2
| | | | | |
Br Br Br Br Br Br
Если две двойные связи разделены одной s - связью, то образуется сопряженная система. В результате этого присоединение не по месту раскрытия той или иной двойной связи, а по концам молекулы, а двойная связь образуется в середине молекулы.
CH2 = CH – CH = CH2 + Br2 ® CH2 - CH =CH – CH2
| |
Br Br
Получение алкадиенов
1. Впервые бутадиен-1,3 был получен в 1932 г. С.В. Лебедевым. Он получил бутадиен -1,3 из этилового спирта.
4250C, Al2O3ZnO
2C2H5OH CH2 = CH – CH = CH2 + 2H2O + H2
2. Дегидрирование предельных углеродов.
t=6000 Rt
CH3 – CH2 - CH2 – CH3 CH2 = CH – CH = CH2 + H2
Применение алкадиенов основано на их способности к полимеризации.
t, kat
N CH2 = CH – CH = CH2 (-VH2 – CH = CH – CH2-)n
В результате полимеризации диенов образуются каучуки, из которых методом вулканизации получают резину.
Вопрос 3. Определить с помощью характерных реакций три органических вещества: глицерин, крахмал, глюкозу.
1. В пробирку наливаем 1мл свежеприготовленного раствора крахмала и добавляем несколько капель йода, наблюдается темно-синее окрашивание раствора.
2. В пробирке получаем осадок Cu(OH)2
CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4
и добавляем его в пробирку с растворами белка и глюкозы. В пробирке с раствором белка наблюдается фиолетовое окрашивание. В пробирке с раствором глюкозы наблюдается синее окрашивание.
Билет 5.
Вопрос 1. Химическое равновесие и условия и его смещения: изменение концентрации исходных веществ, температуры, давления.
План ответа на вопрос.
1. Понятие обратимой реакции.
2. Химическое равновесие.
3. Условия смещения химического равновесия.
- влияние концентрации реагирующих веществ
- давления
- температуры
Обратимыми называются химические реакции, идущие одновременно в двух взаимнопротивоположных направлениях.
пр
N2 + 3H2 2NH3
обр
Обратимые реакции не доходят до конца, а заканчиваются установлением химического равновесия.
Химическое равновесие – это такое состояние системы, при которой скорости прямой и обратной реакций равны. (Vпр = Vобр).
В состоянии равновесия прямая и обратная реакции не прекращаются, поэтому такое равновесие называется подвижным или динамическим. На состояние химического равновесия оказывают влияние:
1. Концентрация веществ.
Если увеличить концентрацию азота и водорода, то скорость прямой реакции возрастает и равновесие сместится в сторону образования NH3. При увеличении концентрации аммиака возрастает скорость обратной реакции, т.е. при увеличении концентрации исходных веществ, увеличивается скорость прямой реакции.
2. Давления.
Изменения давления оказывает влияние только на те системы, в которых хотя бы одно вещество находится в газообразном состоянии.
При увеличении давления уменьшается объем системы, а значит, возрастает их концентрация. При увеличении давления химическое равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных веществ меньше.
В реакции образования аммиака при повышении давления равновесие смещается в сторону образования аммиака, т.к. из 3 моль исходных веществ образуется 2 моль NH3, т.е. объем системы уменьшается.
3. Температуры
При повышении температуры возрастает скорость любой химической реакции. Причем повышение температуры больше сказывается на эндотермических реакциях. Т.е. при повышении температуры химическое равновесие смещается в сторону эндотермической реакции. Направление смещения химического равновесия можно предсказать пользуясь принципом Ле-Шателье:
Если на систему оказывается влияние, то равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет внешнее воздействие.
Вопрос 2. Ацетилен – представитель углеводородов с тройной связью в молекуле. Свойства получения и применение ацетилена.
План ответа на вопрос
1. Понятие алкинов, их общая формула
2. Строение молекулы ацетилена
3. Свойства ацетилена
4. Получение и применение
Алкины – непредельные углеводороды, в молекулах которых имеется одна тройная связь. Их общая формула CnH2n-2 (При ответе использовать таблицу «Ацетилен»). В молекуле ацетилена имеется одна тройная связь. Она образована одной s - и двумя p - связями.
Атомы углерода в молекуле ацетилена находятся в состоянии sp – гибридизации, т.е. образует две гибридные орбитали, которые располагаются под углом в 1800 друг к другу. s - связь образуется при перекрывании гибридных орбиталей атомов углерода.
Не гибридные р – орбитали располагаются перпендикулярно линии молекулы и перекрываясь образует две p - связи. Длина тройной связи 0,12 н.м., т.е. она короче чем двойная и одинарная связи, а следовательно, она прочнее.
Ацетилен - это газ со специфическим запахом, малорастворимый в воде.
Химические свойства
1. Ацетилен горит
2С2H2 + 3O2 ® 4CO2 + 2H2O
2. Вступает в реакции присоединения
- Водорода
Pt
HC º CH + H2 ® H2C = CH2
Ацетилен этилен
Далее реакция идет также, как у алкенов
Pt
H2C = CH2 + H2 ® H3C = CH3
Этилен этан
- Галогенов
HC º CH +Br2 ® HC = CH
½ ½
Br Br
Диброметэн
Br Br
½ ½
HC º CH +Br2 ® HC = CH
½ ½ ½ ½
Br Br Br Br
тетрабромэтан
- Галогенводородов
HC º CH + HCl ® H2C = CHCl
хлорэтен
H2C = CHCl + HCl ® H3C - CHCl
дихлорэтан
- Воды (реакция Кучерова)
Hg2+ O
HC º CH + H2O ® CH3 - C
H
этаналь
3. Тримеризация
C*, 4000C
3HC º CH ®
бензол
Получение
1. Метановый способ
t>15000
2CH4 ® C2H2 + 3H2
продукты этой реакции необходимо быстро охладить, иначе может произойти разложение образовавшегося ацетилена
2. Карбидный способ
CaC2 + 2H2O ® 2Ca (OH)2 + C2H2
А оксид кальция при обжиге CaCO3
t
CaCO3 ® CaO + C2O
Применение
Ацетилен используется для сварки и резки металлов, а также в органическом синтезе для получения уксусного альдегида, а затем уксусной кислоты, винилхлорида и поливинилхлорида и других веществ.
Вопрос 3. Определите объем кислорода, необходимый для полного сжигания 44,8 л метана.
| Дано: V(CH4)=44.8 л | Решение |
| V(O2) -? | 2 моль x
СH4 + 2O2 ® CO2 + 2H2O
1 моль 2 моль

 X = 4 моль
V = n × Vm; V(O2) = 4 моль × 22,4 л/моль = 89,6 л/моль
Ответ: V(O2) = 89,6 л/моль
X = 4 моль
V = n × Vm; V(O2) = 4 моль × 22,4 л/моль = 89,6 л/моль
Ответ: V(O2) = 89,6 л/моль
|
Билет 6
Вопрос 1. Скорость химических реакций. Зависимость скорости химических реакций от природы, концентрация реагирующих веществ, температуры, катализатора.
План ответа на вопрос.
1. Понятие скорости химической реакции
2. Зависимость скорости от:
- природы реагирующих веществ;
- концентрации;
- температуры;
- катализатора;
- поверхности соприкосновении реагирующих веществ
Скорость химической реакции – это изменение концентрации вещества в единицу времени.

Скорость химической реакции зависит:
1. от природы реагирующих веществ;
- скорость гомогенных реакций (однородная среда, например, два газа) равна изменению количества вещества в единицу времени в единице объема:
 , где
, где  , следовательно
, следовательно

- скорость гетерогенных реакций (разнородная среда, например, газ и жидкость) равны изменению количества вещества в единицу времени на единице площади.

2. от концентрации;
Согласно закона действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Т.е. для реакции 2А+В=Д этот закон выразится так:  , где k - коэффициент пропорциональности, СА и Св – концентрации реагирующих веществ.
, где k - коэффициент пропорциональности, СА и Св – концентрации реагирующих веществ.
3. от температуры;
Согласно правила Вант-Гоффа повышение температуры на каждые 100С приводят к увеличению скорости реакции в 2-4 раза.
4. от катализатора;
Катализаторы изменяют скорость реакции, но сами при этом не расходуются. Катализ может быть гомогенным и гетерогенным. При гомогенном катализе вещества и катализатор находится в одной фазе – газовой или жидкой. При гетерогенном катализе вещества и катализатор находятся в разных фазах, например, вещества газы или жидкости, а катализатор – твердое вещество.
5. от площади соприкосновения реагирующих веществ должны быть измельчены, таким образом увеличивается площадь соприкосновения реагирующих веществ и реакция ускоряется.
Вопрос 2. Ароматические углеводороды. Бензол, структурная формула, свойства, получение.
План ответа на вопрос.
1. Понятие ароматических веществ
2. Структурная формула бензола.
3. Физические свойства.
4. Химические свойства.
5. Получение и применение
Ароматическими называются соединения, в молекуле которых имеется циклическая группа атомов с особым характером связи - бензольное ядро. Общая формула CnH2n-6, Простейший представитель - бензол С6Н6. Структурная формула:
или - формула Кекуле (истинного строения не отражает)
Атомы углерода находятся в sp2 - гибридизации, валентные углы – 1200, длина связей С-С равна 0.14 нм, молекула плоская. Три гибридных электронных облака каждого атома углерода образуют s-связи: С-С и С-Н. Облака четвертых р-электронов негибридизированы и, перекрываясь друг с другом над и пол плоскостью s-связей, образуют единую p-электронную систему и 6 р-электронов.
Бензол - токсичная, горючая, нерастворимая в воде жидкость. Строение молекулы бензола определяет его свойства. Реакции замещения напоминают свойства алканов, но протекают легче:
а) галогенирование:
Н Br
+ Br – Br FeBr3 + HBr
Бромбензол
FeBr3
C6H6 + Br2 C6H5 – Br + HBr
б) нитрирование:
H2SO4 конц
С6Н6 + HO-NO2 ® С6H5NO2 + HО2
нитробензол
Реакции присоединения протекают с большим трудом:
- гидрирование:
Pt, Ni
- С6Н6 + ЗН2 C6H12
циклогексан
| Cl |
| H |
| Cl |
| Cl |
| H |
| H |
| Cl |
| H |
| Cl |
| Cl |
| H |
гексахлорциклогексан
Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям (не обесцвечивает бромную воду и раствор КМnО4).
Бензол получают из нефти и каменноугольной смолы. Его можно получать из ацетилена, алканов, циклоалканов (дегидрирование)-
СН2
/ \
Н2С СН2 Pt 3000C
½ ½ + 3H2
Н2С СН2 актив. уголь
\ /
СН2
циклогексан бензол
Бензол - ценный растворитель и важное сырье для получения лекарственных веществ, пластмасс, красителей, ядохимикатов, используется в качестве добавки к моторному топливу.
Вопрос 3. Провести реакции, характеризующие химические кислот (на примере серной кислоты).
При диссоциации всех кислот в растворах образуется катион водорода Н+ (точнее, ион гидроксония Н3О+) именно он и обуславливает все химические свойства кислот.
1. Изменяет окраску индикатора.
В пробирку налить 1 мл раствора H2SO4 и добавить несколько капель синего лакмуса. Раствор окрасится в красный цвет, что говорит о присутствии кислоты.
2. Взаимодействие с металлами.
В пробирку поместить 1-2 гранулы цинка и прилить 1-2 мл раствора H2SO4. Наблюдается выделение газа.
Zn + H2SO4 ® ZnSO4 + H2
Zn0 +2H+ ® Zn+2+ H20
3. Взаимодействие с оксидами металлов.
В пробирку поместить небольшое количество оксида меди (II) (порошок черного цвета), и приливаем 1-2 мл раствора H2SO4 и нагреваем на пламени спиртовки. Наблюдаем: оксид меди растворяется, р-р окрашивается в синий цвет
CuO + H2SO4 ® CuSO4 + H2O
CuO + 2H+ ® Cu2+ + H2O
4. Взаимодействие с солями более слабых кислот.
В пробирку поместить небольшой кусочек мела или мрамора и прилить раствор H2SO4. Наблюдаем выделение газа:
CaCO3 + H2SO4 ® CaSO4 + H2O + CO2
Билет 7.
Вопрос 1. Основные положения теории химического строения органических веществ А.М. Бутлерова. Химическое строение молекул как порядок взаимного влияния атомов в молекулах.
План ответа на вопрос
1. Предпосылки создания теории
2. Основные положения теории
3. Значение теории
Органическая химия как наука оформилась в начале XIX века. В середине XIX века в науке накопилось много фактов о соединениях углерода, количество которых возрастало. Объединить такое многообразие ученые не могли. Еще больше вопросов вызывало существование изомеров. Эти вещества имели одинаковый состав, но проявляли различные химические свойства. В 1853 году было введено понятие валентность. Однако валентность углерода в соединениях углерода, таких как С2Н6 и С3Н8 вызывала еще больше вопросов. В 1857 году немецкий химик Кекуле отнес углерод к 4-х валентным элементам, а в 1858 году вместе с шотландским ученым Купером предположил, что атомы углерода в органических веществах образуют цепи.
Все это явилось предпосылками к созданию теории химического строения органических веществ, которую сформулировал русский химик Александр Михайлович Бутлеров. Основные положения своей теории А.М. Бутлеров впервые представил в 1861 году в докладе «О химическом строении веществ» на съезде немецких естествоиспытателей и врачей в г. Шпейере.
I. Атомы в молекулах соединяются не беспорядочно, а в определенной последовательности согласно их валентности.
II.
Свойства веществ зависят не только от количества атомов, но и от взаимного расположения. Это положение объясняло причину изомерии. Так, например, бутану (С4Н10) соответствуют два вещества, имеющие строение: CH3 – CH2 – CH2 – CH2 CH3 – CH – CH3 H – бутан ½ CH3
2- метилпропан
III. Атомы и группы атомов взаимно влияют друг на друга. Это является следствием того, что молекулы образованы различными по природе атомами (С, Н, О, N, и др.), которые обладают разной электроотрицательностью, т.е. по разному влияют на электронные пары химических связей.
IV. По свойствам данного вещества можно определить состав, а по составу свойства.
Значение теории.
1. Теория углубила представления о строении веществ на атомно – молекулярном уровне.
2. Объяснила факты, накопившиеся в химии.
3. Дала импульс развитию науки.
4. Предсказала новые вещества и указала пути их синтеза.
Вопрос 2. Реакции ионного обмена. Условия их необратимости.
В водных растворах кислоты, основания и соли под действием молекул воды дессоциируют на ионы. При смешивании таких растворов фактическими участниками таких реакций являются ионы.
Реакции между веществами в растворах называются реакциями ионного обмена.
Реакции ионного обмена идут до конца, если какая-либо пара ионов образует недиссоциирующее вещество, которое:
1. Образует осадок:
HCl + AgNO3 ® AgCl¯ + HNO3
Cl- + Ag+ ® AgCl¯
2. Выделяет газ.
Na2CO3 + 2HCl ® 2 NaCl + H2O + CO2
CO32- + 2H+ ® H2O + CO2
3. Образуется вода.
NaOH + HCl ® NaCl + H2O
OH- + H+ ® H2O
Вопрос 3. Определить массу серебра, которое выделится при окислении 0,5 моль уксусного альдегида.
| Дано: O n CH3 – C = 0.5 моль H | Решение: 0.5 моль O O X CH3 – C + Ag2O ® CH3C + 2Ag¯ 1 моль H OH 2 моль |
| m (Ag) -? | X = 1 моль m (Ag) = n × M (Ag) = 1 моль: 108 г/моль = 108 г |
Билет 8.
Вопрос 1. Изомерия органических соединений и ее виды.
Изомерия – это явление существования нескольких веществ, имеющих один и тот же состав, одну и туже молекулярную массу, но различное строение.
Существует несколько видов изомерии:
1. Изомерия углеродного скелета. Характерна для всех органических веществ.
C4H10 – бутан
СH3 – СH2 - СH2 - СH3 СH3 – СH - СH3
½
н. бутан СH3
изобутан
2-метилпропан
2. Изомерия положения кратных связей. Характерна для непредельных угле
 2020-06-29
2020-06-29 111
111







