К правильному представлению о строении атома пришли не сразу. Изначально люди вообще считали, что атом – это наименьшая частица. Именно так и переводится слово «атом» с греческого – неделимый. Так продолжалось до 1897 года, до тех пора, пока Джозеф Томсон не провел опыт с круксовой трубкой. В концах этой трубки были помещены два электрода: катод и анод. Когда на катод подавалось высокое напряжение, он начинал испускать пучки электронов (электроны Томсон называл корпускулами).
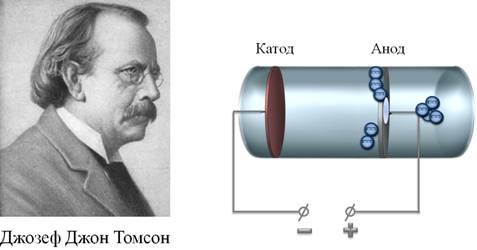
Известно, что испускание электронных пучков обусловлено явлением термоэлектронной эмиссии, о котором говорилось в курсе физики 10 класса. В процессе проведения опыта, Томсон выяснил, что электронные пучки отклоняются под действием магнитного поля.

Исходя из характера отклонения, можно было заключить, что данные частицы имеют отрицательный заряд. Зная, что атом в целом электрически нейтрален, Джозеф Томсон предложил так называемую «пудинговую» модель атома.
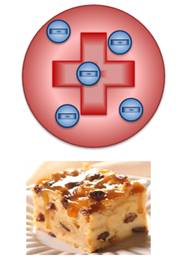
Согласно этой модели облако положительного заряда распределено по всему размеру атома, а внутри этого облака расположены электроны, подобно тому, как изюминки расположены в пудинге. Суммарный отрицательный заряд электронов равен положительному заряду облака. Но от этой модели почти сразу пришлось отказаться: дело в том, что это противоречило уже известному свойству атомов – устойчивости (то есть, тому факту, что атомы существуют в течение длительного времени).
Новую модель атома предложил ученик Томсона – Эрнест Резерфорд. Прежде чем мы обратимся к опытам Резерфорда, обратите внимание на следующие факты: атом в целом электрически нейтрален. При этом, масса электронов, находящихся в атоме, в тысячи раз меньше массы самого атома. Это говорит о том, что основная масса атома приходится на его положительно заряженную часть. Исходя из этого, Резерфорд заключил, что для исследования распределения массы атома, можно исследовать распределение положительного заряда. В 1906 году он предложил бомбардировать тяжелые элементы с помощью a-частиц. На то время уже было известно, что такие частицы испускаются в процессе радиоактивного распада радия. Масса этих частиц в тысячи раз превышает массу электрона. Также, a-частицы обладают положительным зарядом, который по модулю вдвое больше заряда электрона. Наконец, альфа-частицы двигаются с очень большими скоростями (примерно 20000 км/с). Очевидно, что электроны не могут существенно изменить траекторию движения таких частиц. Поэтому, рассеяние (то есть заметное изменение направления движения) альфа-частиц может вызвать только положительная часть атома. Этим фактом и воспользовался Резерфорд, проводя свои опыты в 1911 году.
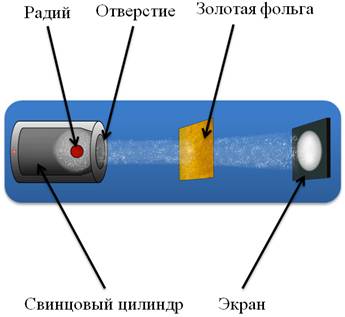
Рассмотрим установку, которая использовалась для проведения данных опытов. В свинцовый цилиндр с узким отверстием помещался радий. Далее располагалась фольга из золота, а за ней – экран. За экраном можно было наблюдать с помощью микроскопа. Вся эта установка располагалась в специальном сосуде, из которого был откачан воздух. Итак, в процессе распада, радий испускал a-частицы, которые при прохождении через фольгу рассеивались. При попадании каждой a-частицы на экран, в микроскоп можно было наблюдать вспышку света (такая вспышка называется сцинтилляцией). Было обнаружено, что если убрать фольгу, то сцинтилляции, возникающие на экране, образуют светлый кружок. Но при наличии фольги, площадь этого кружка увеличивалась. Это свидетельствовало о рассеянии a-частиц при прохождении через фольгу. Но Резерфорд на этом не остановился. Он немного модифицировал исходную установку, с целью выяснить: могут ли a-частицы отклоняться на ещё большие углы? Для этого, он окружил фольгу сцинтилляционными экранами и повторил опыт.
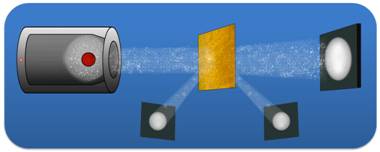
К его великому удивлению, некоторые частицы отклонились на углы, превышающие 90 градусов. То есть, фактически небольшое число частиц были отброшены назад. Действительно, такой результат предвидеть было очень и очень сложно, поскольку расчеты говорили о том, что электрическое поле положительного заряда, распределенного по всему атому, не может быть достаточно сильным, чтобы отбросить a-частицу назад. Напомним, что силу отталкивания можно определить исходя из закона Кулона.
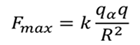
В данной формуле имеется коэффициент пропорциональности k, заряд a-частицы, положительный заряд атома и его радиус.
Напряженность заряженного шара убывает по мере приближения к центру шара и максимальна на поверхности шара. Следовательно, сила отталкивания увеличивается по мере того, как уменьшается радиус. Это навело Резерфорда на мысли о том, что положительный заряд сконцентрирован в очень малой области пространства атома, а не равномерно распределен по всему атому. В связи с этим было введено понятие атомного ядра. Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома. Легко понять, что чем ближе к ядру атома пролетают альфа-частицы, тем больше их отклонение.
Резерфорд подсчитал число частиц, рассеянных на различные углы, и, исходя из полученных данных, оценил размер ядра. Выяснилось, что диаметр ядра составляет порядка 10–14 – 10–15 м, в то время как диаметр атома составляет порядка 10–10 м. Из этого можно заключить, что размеры атомного ядра в десятки, а иногда и в сотни тысяч раз меньше размеров самого атома. Позднее был вычислен и заряд ядра, который можно узнать из таблицы Менделеева. Принимая модуль заряда электрона за единицу, заряд ядра любого химического элемента равен номеру этого элемента в таблице Менделеева. Например, заряд ядра азота равен семи, заряд ядра кислорода равен восьми, заряд ядра алюминия равен тринадцати и так далее.
Эрнест Резерфорд провел серьезные исследования и, основываясь на них, создал планетарную модель атома. Согласно этой модели, в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Поскольку атом электрически нейтрален, число электронов в атоме, также равно порядковому номеру элемента в таблице Менделеева. Разумеется, электроны не могут покоиться внутри атома. Они непрерывно движутся вокруг ядра, подобно тому, как планеты вращаются вокруг Солнца (именно поэтому, модель Резерфорда получила название планетарной модели атома).
Наиболее простым атомом является атом водорода: вокруг его ядра вращается всего один электрон.

Из этого можно заключить, что ядро атома водорода имеет положительный заряд, численно равный заряду электрона. Резерфорд предположил, что ядра всех атомов содержат ядро атома водорода. Это предположение было обусловлено тем, что масса ядра любого химического элемента кратна массе ядра водорода. Поэтому, ядро водорода стало рассматриваться как элементарная частица. Такую частицу назвали протоном.
Таким образом, рассмотрено экспериментальное обоснование справедливости планетарной модели атома. Но эта модель, так же, как и пудинговая модель, не в состоянии объяснить устойчивость атома. Электроны двигаются по определенным орбитам с достаточно большими скоростями. Известно, что любое криволинейное движение является ускоренным, следовательно, при движении электронов имеет место изменение скорости движения. Поэтому, электроны должны испускать электромагнитные волны, причем с частотой, равной частоте обращения вокруг ядра.
Излучая электромагнитные волны, электроны должны терять энергию, а это привело бы к тому, что электроны начали бы приближаться к ядру из-за снижения скорости. Если выполнить соответствующие расчеты, основываясь на классической механике Ньютона, то можно убедиться, что за время порядка 0,01 мкс, электрон должен упасть в ядро. Это приведет к тому, что атом попросту прекратить своё существование. Тем не менее, известно, что ничего подобного не происходит. Большинство атомов устойчивы и могут существовать сколь угодно долго. При этом, конечно, не наблюдается излучение каких-либо электромагнитных волн.
Почему же наблюдения и опыты не согласуются с теорией? Дело, конечно, не в том, что классическая механика является несостоятельной теорией. Дело в том, что к подобным явлениям классическая механика неприменима. К явлениям, происходящим внутри атомов нужно применять квантовую механику.
Основные выводы:
– В результате исследований Резерфорда была предложена планетарная модель атома.
– Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
– Ядро атома водорода рассматривается как элементарная частица и называется протоном.
– Процессы, происходящие внутри атомов необходимо рассматривать с точки зрения квантовой механики.
– Планетарная модель атома, созданная Резерфордом, обоснована экспериментально, но, тем не менее, данная модель не объясняет устойчивость атома.
 2020-06-29
2020-06-29 1130
1130
