В простейшем случае, когда в элементарном акте реагируют две одинаковые частицы, 2A → продукты скорость реакции связана со скоростью образования исходного вещества А соотношением

По закону действующих масс 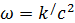 подстановка дает
подстановка дает

где k = 2k'. В результате решения получаем

Размерность константы скорости реакции второго порядка — (концентрация)-1 * (время)-1, например л/(моль с).
Для периода полураспада получаем

Эти уравнения справедливы для реакций второго порядка, если между собой реагируют разные частицы, но концентрации веществ одинаковы
A1 + А2 → продукты.
Если концентрации веществ А1 и А2 разные, то для константы скорости реакции получаем

где x — уменьшение концентрации веществ A1 и A2 ко времени t;
c1,0, c2,0 — начальные концентрации исходных веществ.
РЕАКЦИИ ТРЕТЬЕГО ПОРЯДКА
Такие реакции очень редки. Для элементарной реакции третьего порядка 3A → продукты или A1 + A2 + A3 → продукты, при одинаковой концентрации исходных веществ, получим 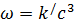 . Для скорости реакции справедливо также выражение
. Для скорости реакции справедливо также выражение

Отсюда

где k = 3k'.
Разделив переменные и проинтегрировав получим выражение

Для периода полураспада получаем выражение

РЕАКЦИИ НУЛЕВОГО ПОРЯДКА
Реакции нулевого порядка — это реакции, для которых скорость реакции не зависит от концентрации и не меняется во времени. В этом случае имеем

Интегральные формы кинетического уравнения будут иметь вид




где х — число молей исходного вещества, прореагировавшего ко времени t.
 2020-07-01
2020-07-01 106
106








