Ферменты, катализирующие окислительно-восстановительные реакции относятся к классу оксидоредуктаз. Окидоредуктазы – I класс ферментов, относящиеся к сложным белкам, т.к. являются двухкомпонентными молекулами, коферментами которых являются моно- и динуклеотиды (производные витаминов РР и В2 – НАД+, НАДФ+, ФАД, ФМН), производные протопорфиринов (гем), хиноны, ионы металлов, дигидробиоптерин. Коферменты всех оксидоредуктаз играют роль промежуточных акцепторов электронов. Оксидоредуктаза с восстановленным коферментом не может участвовать в катализе реакции до тех пор, пока электроны ее кофермента не будут переданы на конечный акцептор. Отношение восстановленный кофермент/окисленный кофермент является важным фактором, регулирующим окислительно-восстановительные реакции в клетке. В зависимости от типа конечного акцептора все окислительно-восстановительные реакции можно разделить на аэробные (конечный акцептор кислород) и анаэробные (конечный акцептор не кислород, а др. соединения). По способу передачи электронов, которым пользуются оксидоредуктазы, различают:
· дегидрогеназы – катализируют реакции дегидрирования (отщепления водорода);
· оксидазы – катализируют реакции присоединения электронов к кислороду;
· оксигеназы (гидроксилазы) – катализируют внедрение атома кислорода по С-Н связи субстрата (создание гидроксильной группы);
· гидропероксидазы – способствуют образованию перекиси водорода в фагоцитарных и др. клетках.
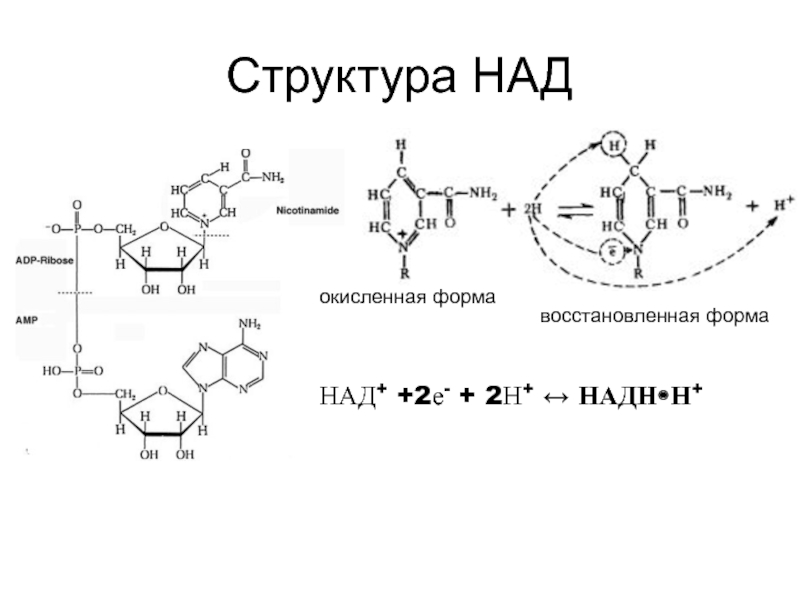
НАД+ и НАДФ+ представляют собой коферменты большого числа дегидрогеназ; связь между ними и апоферментом непрочная, и они ассоциируют между собой только в момент реакции. Дегидрогеназы данного типа катализируют перенос гидрид-иона (второй протон остается в среде). В присутствии восстановленного субстрата (DH2) – донора электронов и соответствующей дегидрогеназы пиридиновое кольцо восстанавливается путем связывания в четвёртом положении одного протона (гидрид-иона) и двух электронов, второй протон остаётся в среде:
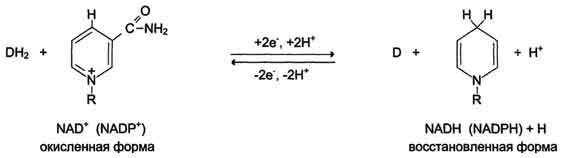
НАД+-зависимые дегидрогеназы локализованы в основном в матриксе митохондрий. Их окисление осуществляется I комплексом дыхательной цепи (см. ниже) – НАДН:КоQ – оксидоредуктазой.
НАДФ+-зависимые дегидрогеназы – это преимущественно цитоплазматические ферменты, и их восстановленные формы являются донорами восстановительных эквивалентов в реакциях биосинтеза.
Таким образом, незначительные различия в структуре НАД+ и НАДФ+ (НАД+ построен из двух мононуклеотидов, один из которых – адениловая кислота, а во второй входят остатки никотинамида (витамина РР), рибозы и фосфата; в молекуле НАДФ+ имеется дополнительная фосфатная группа, присоединенная к С2ʹ атому рибозы адениловой кислоты кофермента) не отражаются на механизме их участия в переносе электронов, но придают им разные функции в клетке:
· восстановленная форма НАДН•Н+ поставляет электроны в реакции, обеспечивающие образование макроэргов;
· НАДФН•Н+ - для анаболических процессов (восстановительные синтезы) или для реакции обезвреживания ксенобиотиков и активных форм кислорода.
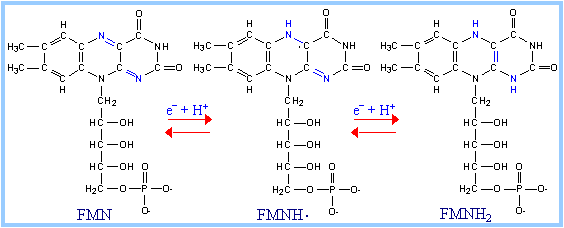
ФМН и ФАД обладают способностью передавать электроны прямо на кислород. Такие дегидрогеназы получили название оксидаз. Коферменты прочно связаны с апоферментом, выступая в роли простетической группы, а не свободно диссоциирующих коферментов. Обе группы представляют собой метаболически активную форму рибофлавина (витамина В2). В отличие от НАД+/НАДФ+ - зависимых дегидрогеназ (которые одновременно переносят два электрона), коферменты флавиновых дегидрогеназ могут переносить и по одному, и по два электрона. Принимая один электрон, связанный с ферментом ФМН, превращается в радикал семихинона, который может присоединять второй электрон с образованием полностью восстановленной формы ФМНН2. Способность принимать один или два электрона придает флавинзависимым дегидрогеназам важное качество: они могут связывать между собой переносчиков двух электронов (НАДФН•Н+) с одноэлектронными переносчиками (например, Fe3+, входящими в состав железо-серных белков дыхательной цепи):
a) НАДН•Н+ + ФМН → НАД+ + ФМНН2;
b) ФМНН2 + Fe3+ → ФМНН• + Fe2+ + Н+, после того, как Fe2+ окислится следующим акцептором, ФМН передаст ему фторой электрон:
ФМНН• + Fe3+ → ФМН + Fe2++ Н+.
Итак, флавинзависимые дегидрогеназы, в отличие от никотинзависимых, обладают способностью непосредственно передавать электроны прямо на кислород (поэтому являются оксидазами). Результатом передачи является образование перекиси водорода (Н2О2).
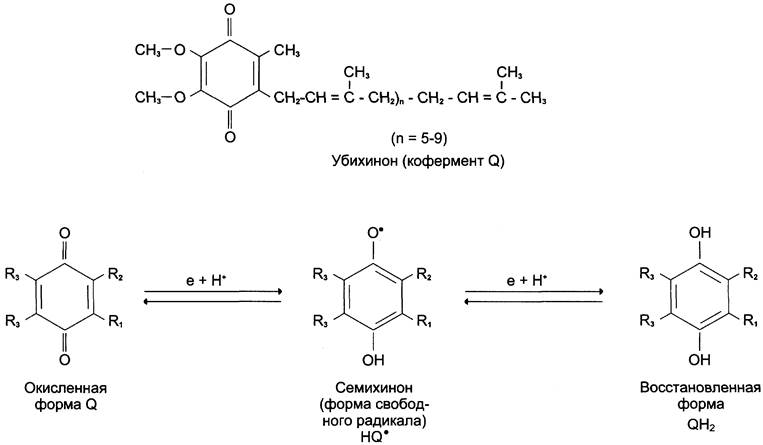
Хиноны (коэнзим Q, убихинон).
Коэнзим Q (КоQ) – это небольшая молекула, производное бензохинона с длинной боковой цепь, которая в большинстве тканей млекопитающих и человека состоит из 10 изопреновых единиц (КоQ10). Установлено, что убихинон играет роль промежуточного переносчика водородных атомов, т.е. электронов и протонов в митохондриальной мембране от I и II комплексов дыхательной цепи, окисляя восстановленную форму флавиновых ферментов, а также способен захватывать протоны из матрикса, превращаясь в восстановленную форму КоQН2. Он может передвигаться в липидной фазе мембраны (продольно и латерально) и передавать 1 е- или 2 е- к другим ферментам дыхательной цепи, получивших название цитохромов, а протоны высвобождаются в межмембранное пространство митохондрий.
Запомните!
До КоQ был 2-х электронный перенос, после КоQ – одноэлектронный.
Как всякий хинон КоQ может существовать в окисленной и восстановленной формах (гидрохинон):
Цитохромы.
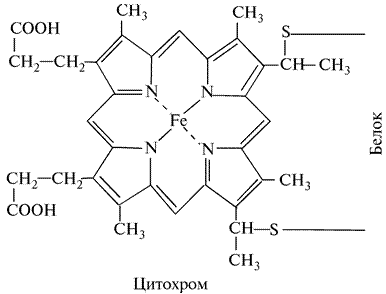
В 1925 г. Кейлиным была открыта ещё одна группа переносчиков электронов – цитохромы. Это электронпереносящие белки-фермены, молекула которых содержит гем и гемоподобные структуры в качестве простетической группы. В отличие от дегидрогеназ, они переносят по одному электрону. Исполнительным элементом в цитохромах является атом железа, способный менять свою валентность:
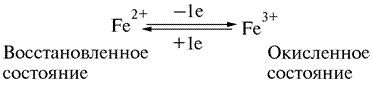
Цитохромы относятся к одноэлектронным окислительно-восстановительным соединениям. Они не могут принимать или отдавать водород, поэтому их называют переносчиками электронов. Известно около 30 различных цитохромов, которые в зависимости от способности поглощать свет разделяются на группы, обозначаемыми строчными английскими буквами (a, b, c и т.д.). внутри каждой группы отдельные виды цитохромов обозначаются цифровыми индексами – b1, b2, b5 и т.д.
Цитохромы различаются:
1. по радикалам в порфириновом кольце;
2. по строению апофермента;
3. по типу связи просетической группы с апоферментом.
Цитохромы располагаются в митохондриальной цепи между убихиноном и кислородлом в определенной последовательности:
b → c1 → c → aa3
Цитохромы b, c1 и c выполняют функцию промежуточных переносчиков электронов, а комплекс цитохромов aa3, который называется цитохромоксидазой, является терминальным дыхательным ферментом, непосредственно взаимодействующий с кислородом. В цитохроме a простетическая группа через пятую координационную связь железа соединяется с аминогруппой аминосахара, входящего в апофермент, а шестая координационная связь остается свободной. При переносе электрона валентность атома железа меняется: Fe3+ ↔ Fe2+. К шестой координационной связи железа цитохрома a могут присоединяться такие группировки атомов, как HCN, H2S, CO. При этом валентность железа становится постоянной (Fe3+) и поток электронов прекращается. На этом основан механизм действия дыхательных ядов.
Цитохромоксидза (комплекс aa3) состоит из 6 субъединиц (2 –и 4 - a3). В цитохроме a3 имеются атомы меди (Cu2+). Электроны принимаются субъединицами a и передаются цитохрому a3, который передает их далее на кислород. Перенос электронов комплексом aa3 включает следующие реакции:
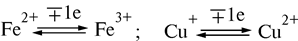
Окисленная форма цитохрома a (Fe3+) принимает электроны от восстановленного цитохрома c, переходя в восстановленную форму (Fe2+), которая затем вновь окисляется в Fe3+ передавая электроны на атомы Cu2+ цитохрома a3. Этот процесс также сопровождается изменением валентности меди. Атом кислорода, локализованный в углублении цитохрома a3 с матричной стороны, заряжается отрицательно и приобретает способность взаимодействовать с 2-мя протонами водорода из матрикса, в результате чего образуется молекула воды.
Fe-S белки.
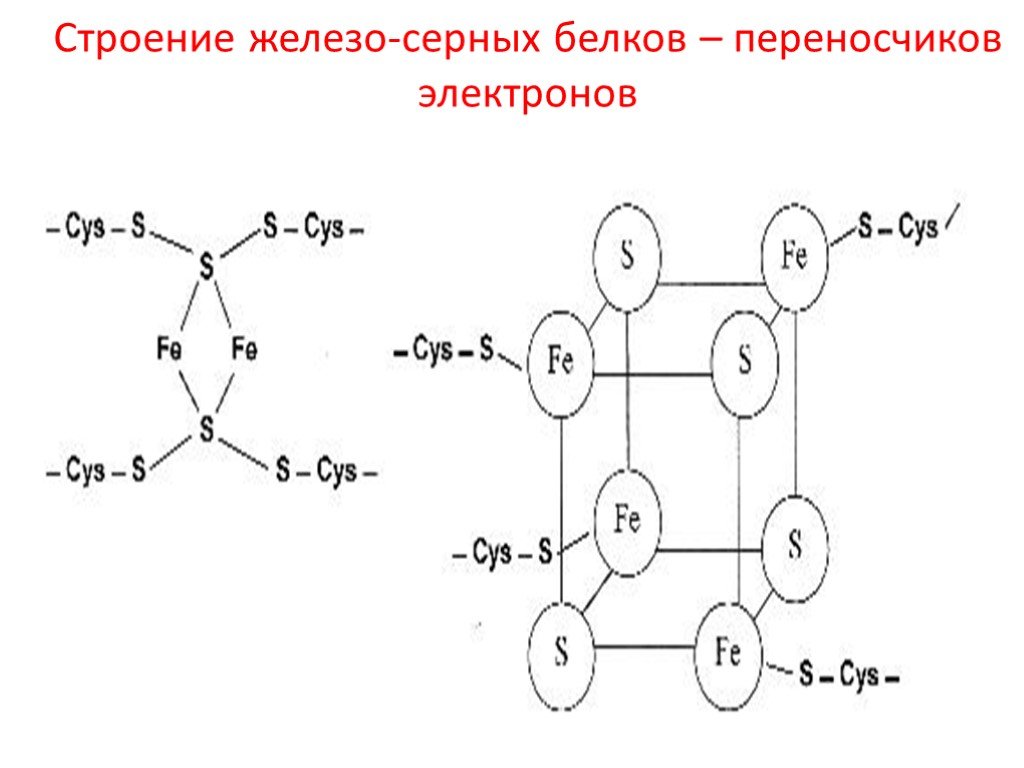
Кроме железа, входящего в состав цитохромов, в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий при помощи ферментов ЦПЭ, принимают участие еще одна группа белков, получивших название железо-серных белков (или комплексов). Они входят в состав I, II и III комплексов дыхательной цепи (см.ниже), выполняя роль второй простетической группы в процессе транспорта электронов. Их основная функция – «ловушка электронов». Железо в их составе – негемовое (негеминовые), поэтому их назвали негемовыми железопротеинами.
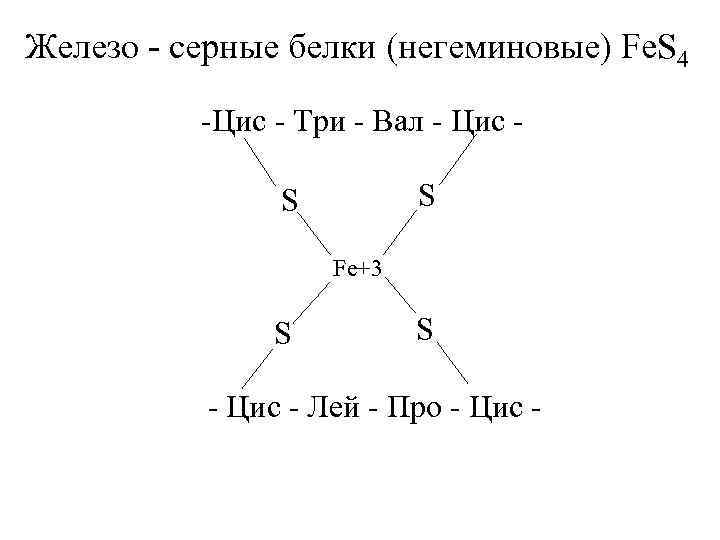
Атомы железа связаны координационными связями с 4-мя атомами серы 4-х цистеиновых остатков в белке (S2-).
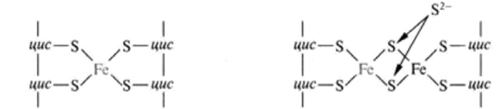
Эти белки играют важную роль в соединении 2-х электронных переносчиков с 1-о электронными в ЦПЭ.
Перечисленные выше белки и ферменты (кроме цитохромоксидазы) используют три из четырех механизмов переноса электронов:
1. перенос электронов (цитохромы и FeS – белки);
2. перенос электронов в составе гидрид-ионов (НАД+ - зависимые дегидрогеназы);
3. перенос электронов в составе атомов водорода (ФМН, ФАД-зависимые дегидрогеназы).
 2020-07-12
2020-07-12 455
455








