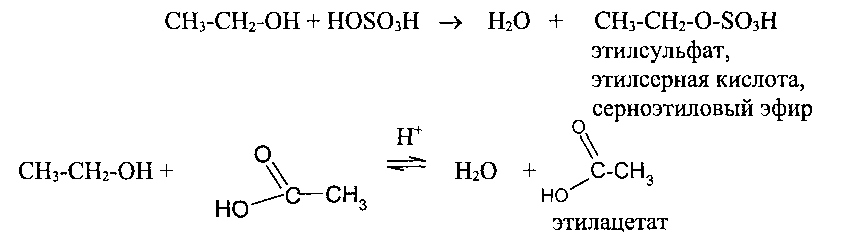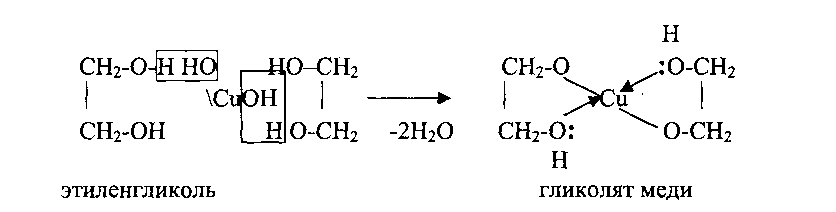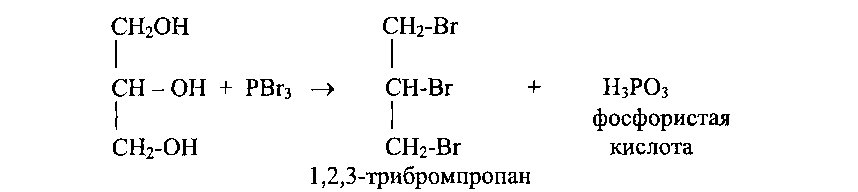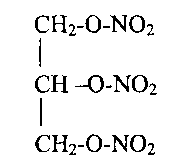- каталитическое гидрирование тиолов («обессеривание»)
- восстановление дисульфидов в биологических условиях
III. Задания для самостоятельной работы
Задание 1. Напишите уравнение реакции окисления бутаналя перманганатом калия в кислой среде.
Задание 2. Напишите уравнение реакции окисления пропена разбавленным раствором перманганата калия в нейтральной среде
Задание 3. Напишите уравнение реакции окисления пропина перманганатом калия в кислой среде
Задание 4. Напишите уравнение реакции окисления толуола перманганатом калия в кислой среде
Задание 5. Напишите уравнение реакции восстановления бутаналя.
Задание 6. Напишите уравнение реакции восстановления нитробензола
Задание 7. Напишите уравнение реакции восстановления бутанона.
Задание 8. Напишите уравнение реакции окисления бутена -2 перманганатом калия в кислой среде при нагревании (жесткое окисление)
Занятие 4.
Тема: Спирты. Определение и классификация спиртов. Изомерия и номенклатура. Физические свойства. Химические свойства.
Цель занятия: Повторить из школьного курса классификацию, изомерию и номенклатуру спиртов. Изучить физические и химические свойства.
I. Вопросы к занятию.
1. Общая классификация спиртов. Предельные одноатомные спирты, их гомологический ряд, общая формула, изомерия, номенклатура.
2. Основные химические реакции: окисления; замещения (образование алкоголятов, простых и сложных эфиров, галогенпроизводных); дегидрирования и дегидратации спиртов.
II. Краткая теоретическая часть.
Производные углеводородов, в которых один или несколько атомов водорода замещены на ОН-группы, называют спиртами.
Классификация:
1) по атомности - по количеству ОН-групп на одно- и многоатомные спирты;
2) по характеру радикала - предельные и непредельные; алифатические и ароматические;
3) по характеру атома углерода, с которым связана ОН-группа, - первичные, вторичные, третичные спирты.
Наибольшее значение имеют предельные одноатомные спирты. Состав членов ряда предельных одноатомных спиртов может быть выражен общей формулой — СnH2n+1ОН или R-OH.
Номенклатура:
Несколько первых членов гомологического ряда спиртов и их названия по радикально-функциональной, заместительной и рациональной номенклатурам соответственно приведены ниже:
CH3OH метиловый метанол карбинол
спирт
C2H5OH этиловый этанол метилкарбинол
спирт
н-С3Н7ОН пропиловый пропанол этилкарбинол
спирт
н-С4Н9ОН бутиловый бутанол пропилкарбинол
спирт
н-С5Н11OН амиловый пентанол бутилкарбинол
спирт
По радикально-функциональной номенклатуре название спиртов образуется из названия радикалов и слова «спирт», выражающего функциональное название класса.
Международная заместительная номенклатура: к заместительному названию углеводорода, производным которого является спирт, добавляют окончание –ол (алканолы). Локант указывает номер атома углерода, при котором расположен гидроксил. Главная углеродная цепь выбирается таким образом, чтобы она включала углерод, несущий гидроксильную группу. Начало нумерации цепи так же определяет гидроксил.
Рациональная номенклатура: все спирты рассматриваются как производные метанола (СН3ОН), который в данном случае называется карбинолом: и в котором водородные атомы замещены на один или несколько радикалов. Название спирта составляют из названий этих радикалов и слова – карбинол.
Изомерия и номенклатура бутиловых спиртов (С4Н9ОН)
| Формула и строение | Название | ||
| Радикально- функциональное | заместительное | рациональное | |
| СН3—СН2—СН2—СН2—ОН | бутиловый спирт (первичный) | 1-бутанол | пропилкарбинол |
| СН3—СН2—СН—СН3 ç ОН | втор-бутиловый спирт | 2-бутанол | метилэтил карбинол |
| СН3 ç СН3—СН—СН2—ОН | изобутиловый спирт(первичный) | 2-метил- пропанол-1 | изопропил карбинол |
| СН3 ç СН3—С—ОН ç СН3 | трет-бутиловый спирт | 2-метил- пропанол-2 | триметил карбинол |
Изомерия
Структурная– 1) изомерия углеродного скелета; 2) изомерия положения ОН- группы; 3)межклассовая (изомерны простым эфирам).
Метиловый и этиловый спирты не имеют изомеров. В зависимости от положения гидроксильной группы при первичном, вторичном или третичном углеродном атоме спирты могут быть первичными, вторичными, третичными.
Физические свойства
Газов в гомологическом ряду нет. Это жидкости. Начиная с С12Н25ОН до С20Н41ОН – маслообразные и с С21Н43ОН — твердые вещества.
В спиртах имеет место ассоциация молекул друг с другом за счет образования водородной связи. [Длина водородной связи больше обычной связи –ОН, а прочность значительно меньше (раз в 10).] Поэтому метанол-жидкость, а метан-газ. Чтобы разрушить водородные связи, надо затратить энергию; это может быть осуществлено при нагревании спирта.
Спирты легче воды: их плотности меньше 1. Метиловый, этиловый и пропиловый спирты смешиваются с водой во всех соотношениях. По мере усложнения углеводородных радикалов растворимость спиртов резко падает. Бутиловый спирт растворяется частично. Высшие спирты в воде не растворяются, т.е. выталкиваются из воды.
Химические свойства.
Химические свойства обуславливаются, главным образом, присутствием в них реакционноспособной гидроксильной группы. Реакции идут с разрывом связи либо R-OH (реакция SN), либо О-Н (кислотность).
1. Кислотные свойства.
При взаимодействии спиртов со щелочными металлами атомы водорода гидрокси-группы замещаются металлом с образованием алкоголята спирта:
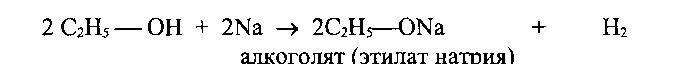
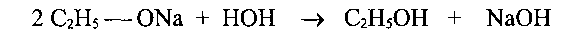
Эти реакции доказывают слабые кислотные свойства.
2. Взаимодействие с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:
|
|
3. Действие на спирты водоотнимающих веществ - межмолекулярное или внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты (конц.H2SO4, Н3РО4, щавелевая и др.), оксиды (оксиды алюминия, тория и др.), некоторые соли (сульфат меди, хлористый цинк и др.).
При межмолекулярной дегидратации спиртов получаются простые эфиры (R-0-R):
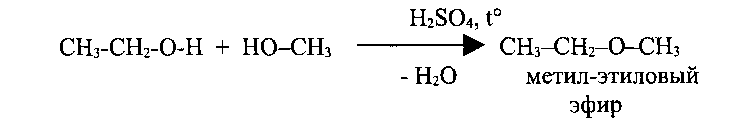
В случае внутримолекулярной дегидратации спиртов, проходящей на тех же катализаторах, но при более высокой температуре, образуются непредельные углеводороды. При этом водород отщепляется от наименее гидрогенизированного атома углерода, находящегося по соседству с углеродом, несущим гидроксильную группу (правило Зайцева):
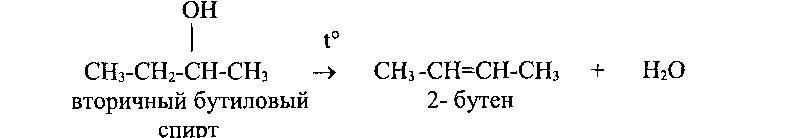
Скорость выделения воды возрастает при переходе от первичных к третичным спиртам; последние дегидратируются даже при простой перегонке.
4. Действие галогенопроизводных фосфора или галогеноводородов - превращение в галогеноалканы:
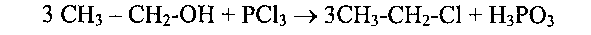
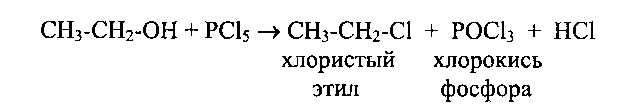
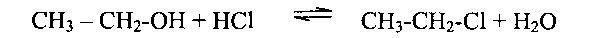 5. Окисление кислородом воздухав присутствии медных и других катализаторов при 300°-500°С, такими окислителями, как хромовая смесь, перманганат калия и др., а также дегидрируются при 100-180°С над Си, Ag, Ni и т.д.
5. Окисление кислородом воздухав присутствии медных и других катализаторов при 300°-500°С, такими окислителями, как хромовая смесь, перманганат калия и др., а также дегидрируются при 100-180°С над Си, Ag, Ni и т.д.
Во всех этих случаях первичные спирты дают альдегиды (при дальнейшем окислении - кислоты с тем же числом углеродных атомов), вторичные спирты - кетоны, которые могут быть окислены дальше до двух кислот с разрывом углеродной цепи:
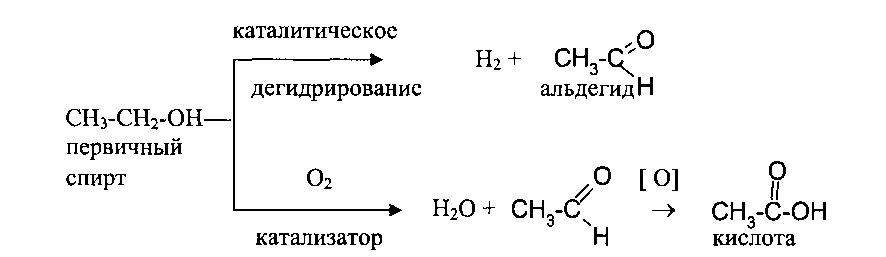
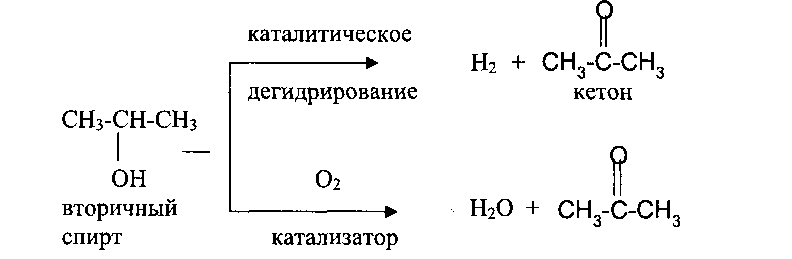
6. Замена гидроксила на аминогруппу: в жестких условиях (300°С, окись алюминия) гидроксильная группа может быть заменена на аминогруппу
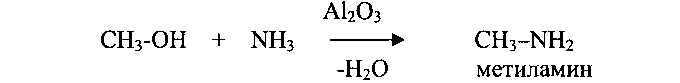
Многоатомные спирты
Многоатомные спирты (гликоли, глицерины) хорошо растворимы в воде, имеют высокие температуры кипения, имеют сладкий вкус. В химические реакции вступают как одна, так и все гидроксильные группы, давая полные и неполные продукты реакции (см. «Одноатомные спирты»). Увеличение числа гидроксильных групп усиливает кислотный характер.Поэтому многоатомные спирты образуют соли под действием не только щелочных металлов, но и гидроксидов тяжелых металлов. При этом образующиеся соли имеют комплексный характер и называются «хелатами» («клешня краба»):
|
|
|
|
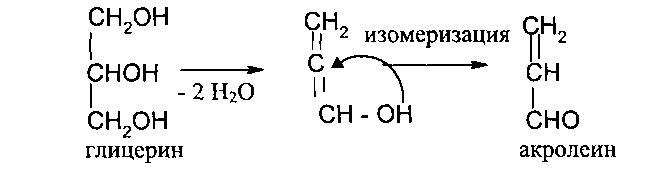
При нагревании глицерина с водоотнимающими веществами (например, бисульфат калия) образуется простейший непредельный альдегид акролеин, обладающий острым неприятным запахом и раздражающим действием на слизистые оболочки глаз, носа и дыхательных путей:
| При действии галогенидов фосфора замещаются галогеном все три гидроксила:
|
Из производных глицерина наибольший интерес представляет тринитроглицерин - сложный эфир (взрывчатое вещество, применяемое для изготовления динамита). В малых количествах оно используется как средство для расширения кровеносных сосудов сердца:
|
|
 2020-07-12
2020-07-12 330
330