Определение хлорамфеникола в молоке методом иммунохроматографического анализа.
Курсовая работа студента 210 группы
Бойченко И.В.
Научный руководитель:
н.с., к.х.н. Андреева И.П.
Преподаватель:
кхн, доц. Пасекова Н.А.
Москва 2020
Оглавление
1 Введение. 2
2 Обзор литературы.. 4
2.1 Иммунохроматографический анализ. 4
2.1.1 Общие принципы ИХА.. 4
2.1.2 Основные компоненты тест-систем.. 7
2.1.3 Метки в иммунохроматографическом анализе. 9
2.2 Хлорамфеникол. 15
2.3 Существующие методы определения хлорамфеникола. 16
3 Экспериментальная часть. 19
3.1 Химические реагенты и биологические препараты.. 19
3.2 Оборудование. 19
3.3 Приготовление растворов. 20
3.4 Методы исследований. 20
3.4.1 Получение конъюгатов сукцината ХАФ с БСА (ХАФ-БСА). 20
3.4.2 Получение наночастиц золота. 21
3.4.3 Получение конъюгата наночастиц золота с антителами. 21
3.4.4 Изготовление иммунохроматографической тест-полоски. 21
3.4.5 Проведение иммунохроматографического анализа. 22
3.5 Определение аналитических характеристик. 22
4 Результаты и их обсуждение. 23
4.1 Получение иммунореагентов. 23
4.2 Разработка иммунохроматографической тест-системы для определения ХАФ 25
4.3 Определение хлорамфеникола в молоке. 29
5 Выводы.. 32
6 Список литературы.. 33
Введение
В настоящее время так называемые «быстрые методы» проведения анализа различных соединений c визуальной регистрацией результатов нашли широкое применение в самых различных областях: медицинской диагностике, фармацевтической и пищевой промышленности, ветеринарии, охране окружающей среды и т.д. Использование этих методов обусловлено коротким временем анализа (5-20 мин), простой и доступной процедурой определения, не требующей дорогостоящего оборудования, возможностью проведения анализа во внелабораторных условиях, высокой чувствительностью, низкой стоимостью и др. Наиболее распространенным вариантом являются методы латерального проточного иммуноанализа или иммунохроматографического анализа (ИХА), которые основаны на использовании мембранных носителей с заранее нанесенными на них реакционными компонентами, позволяющими выявлять наличие определяемого соединения по окрашиванию тестовой зоны мембраны [[1], [2]]. Этот вид анализа позволяет в течение нескольких минут определить и оценить содержание различных биологически активных соединений, в частности, антибиотиков в пищевых продуктах.
Антибиотики широко используются в ветеринарии для лечения и профилактики ряда заболеваний животных, птиц, пчел, рыбы, ракообразных и др. Одним из таких антибиотиков является хлорамфеникол (ХАФ) или левомицетин – антибиотик широкого спектра действия, характеризующимся хорошими антибактериальными и фармакокинетическими свойствами [[3]]. Но наличие остаточных количеств антибиотиков в молоке, мясе и других продуктах может негативно сказываться на здоровье человека. Так, ХАФ является гемотоксичным веществом, способным вызывать аплазию костного мозга и, как следствие, апластическую анемию. В связи с этим в ряде стран (Россия, страны ЕС, США, Канада и др.) использование ХАФ было запрещено и установлен минимально допустимый уровень остаточного количества антибиотика в продуктах питания. Однако вследствие высокой эффективности ХАФ и низкой стоимости его до сих пор (часто незаконно) иногда применяют в ветеринарной практике. Определение остаточного количества данного антибиотика в пищевых продуктах является важной аналитической задачей. Для проведения таких анализов необходимы простые и быстрые, но высокочувствительные и надежные диагностические методы.
Целью настоящей работы является создание высокочувствительной иммунохроматографической тест-системы для количественного определения концентрации хлорамфеникола в молоке. Решению этой задачи посвящена данная курсовая работа.
Обзор литературы
Иммунохроматографический анализ
Общие принципы ИХА
Иммунохроматографический метод анализа (ИХА) основан на принципах тонкослойной хроматографии и включает в себя реакцию между антигеном и соответствующим ему антителом с образованием специфических иммунокомплексов, которые можно регистрировать визуально при помощи меток [2]. В качестве меток используют окрашенные латексы, квантовые точки, магнитные частицы и другие. Но наиболее широкое распространение в методах ИХА получили наночастицы золота (НЧЗ) благодаря легкости получения частиц заданного размера и высокой чувствительности визуальной детекции [[4]].
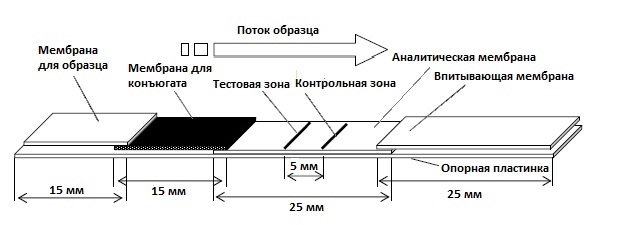
ИХА проводится при помощи специальных мембранных полосок, которые включают в себя все необходимые реагенты, т.е. для проведения анализа достаточно лишь добавить анализируемый образец. Тест-полоска состоит из четырех частей (рис. 1), размещенных на опорной пластинке (как правило, пластиковой) [1].
1. Мембрана для нанесения образца – специальная мембрана, с которой начинается движение образца вдоль полоски под действием капиллярных сил.
2. Мембрана для конъюгата – здесь нанесен конъюгат специфических антител/антигенов с красящей меткой.
3. Аналитическая мембрана – мембрана, в тестовой зоне которой в виде линий прочно иммобилизованы специфические антитела или антигены, а в контрольной зоне расположены вторичные антитела, которые являются индикатором правильности проведения анализа.
4. Впитывающая мембрана – обеспечивает равномерное движение образца вдоль полоски.
| Рис. 1. Типичный вид тест-полоски для ИХА |
 мембраны был немного сверху начала следующей. Это обеспечивает равномерный перенос компонентов образца между частями тест-полоски.
мембраны был немного сверху начала следующей. Это обеспечивает равномерный перенос компонентов образца между частями тест-полоски.
Различают две основные схемы иммунохроматографического анализа: прямая и конкурентная.
1. Прямая или сэндвич схема ИХА (рис. 2) используется для обнаружения высокомолекулярных соединений, таких как вирусы, белковые гормоны, возбудители инфекционных заболеваний.
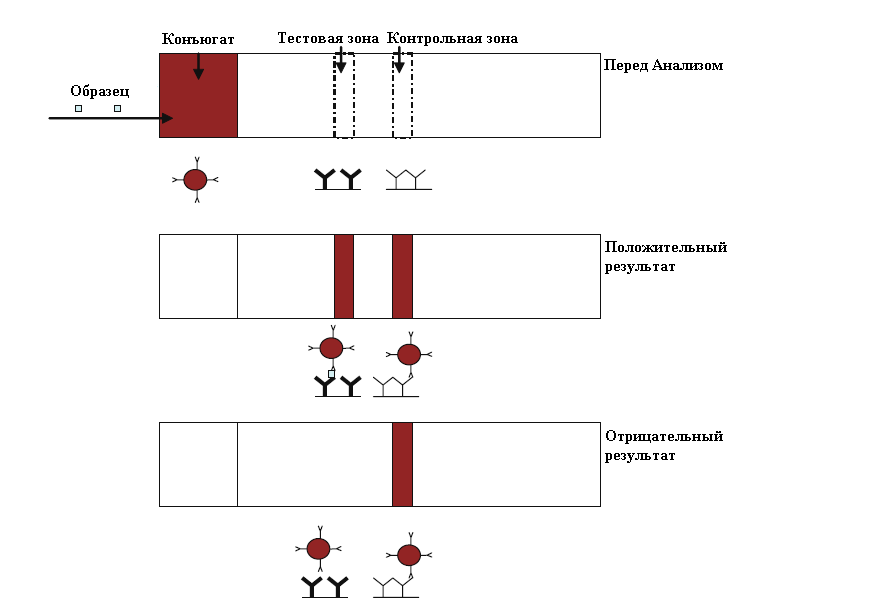
Рис. 2. Схема прямого ИХА [ [5] ]
В данной схеме используется конъюгат специфических антител с красящей меткой (в случае визуальной оценки результата), нанесенный на мембрану для конъюгата. В тестовой зоне иммобилизованы антитела, специфические к аналиту, а в контрольной – антивидовые антитела, специфические к первичным антителам. При нанесении образца, содержащего анализируемое вещество, по мере продвижения вдоль полоски на мембране с конъюгатом происходит связывание аналита с мечеными антителами. Затем образовавшийся иммунный комплекс попадает в тестовую зону, где связывается с иммобилизованными специфическими антителами, образуя «сэндвич». Это проявляется в виде образования окрашенной линии, интенсивность окраски которой пропорциональна концентрации аналита в образце. Избыток несвязавшегося конъюгата связывается с антивидовыми антителами на контрольной линии. Выявление 2-х линий на тест-полоске является положительным результатом теста. При отсутствии аналита в образце конъюгат связывается с антивидовыми антителами только на контрольной линии, образуя одну линию на тест-полоске.
2. Для обнаружения низкомолекулярных соединений в ИХА используются методы конкурентного анализа или непрямая схема (рис. 3).
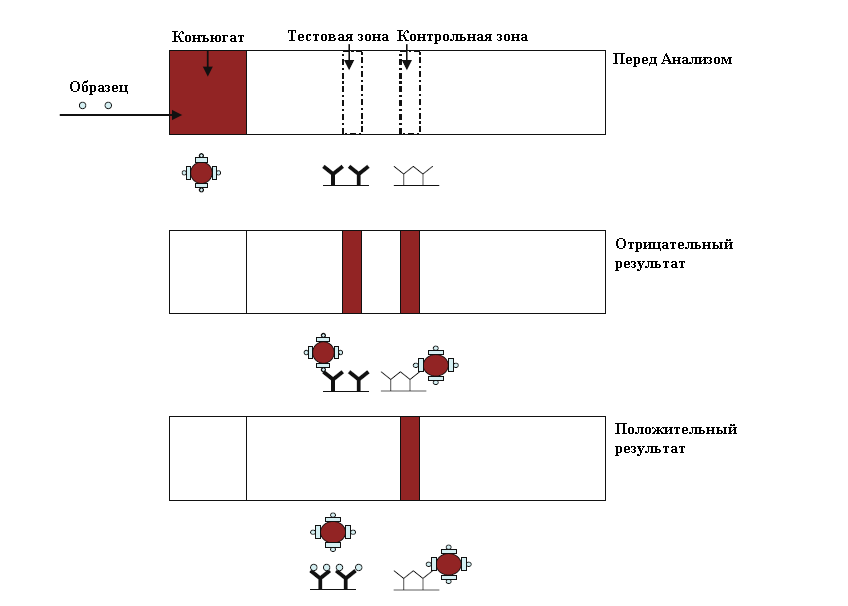
Рис. 3. Схема конкурентного ИХА [5]
В данном методе анализа свободный аналит в растворе образца конкурирует с нанесенным в тестовой зоне аналитом за связывание со специфическими антителами, мечеными коллоидными частицами золота. Интенсивность окраски тестовой зоны будет обратно пропорциональна концентрации определяемого вещества в образце. В результате, отсутствие окрашенной полосы в тестовой зоне свидетельствует о том, что концентрация определяемого вещества в исследуемом образце превышает его пороговое значение для данного теста, а наличие двух окрашенных линий (тестовой и контрольной) является отрицательным результатом анализа [[6]].
Основные компоненты тест-систем
Аналитическая мембрана.
Аналитическая мембрана тонкая и хрупкая, поэтому она крепится на пластиковый или нейлоновый опорный слой, чтобы ее можно было резать и брать руками. Чаще всего ее делают из нитроцеллюлозы, хотя используют и другие доступные материалы, например нейлон, полиэфирсульфон, полиэтилен.
Размер пор мембран на основе нитроцеллюлозы составляет от 0,05 до 15 мкм. Однако не только размер пор мембраны и материал, из которого она сделана, но и скорость переноса анализируемого образца вдоль полоски играет роль, поскольку она влияет на оптимальное время анализа [2].
На аналитической мембране располагаются иммобилизованные компоненты – специфические иммунореагенты. Обычно их наносят на специальном приборе в виде узких линий, находящихся недалеко друг от друга. Материал мембраны влияет на ее сорбционные свойства. Нитроцеллюлозные мембраны связываются с белками за счет диполь-дипольных взаимодействий между нитроэфирными группами мембраны и карбнонильными группами пептидных связей белков. В случае полиэфирсульфоновых мембран связывание происходит за счет гидрофобного эффекта, а в случае нейлона действуют ионные и электростатические силы [2].
Поверхностно-активные вещества.
Поскольку большинство мембран для тестов имеет гидрофобную нитроцеллюлозную основу, для улучшения смачиваемости мембраны вводят поверхностно-активные вещества (ПАВ) [5,[7]].
Введение ПАВ может оказывать влияние на следующие процессы:
· Капиллярная скорость протекания раствора вдоль мембраны.
Чтобы придать смачиваемость мембране, в ее поры вводят определенное количество ПАВ. Чаще всего это количество обеспечивает максимальную скорость потока жидкости вдоль мембраны.
· Адсорбция белков.
Введение различного рода ПАВ может оказать сильное влияние на сорбционные свойства мембраны. Избыток вводимых веществ может приводить к уменьшению количества белка, которое способна сорбировать на себе мембрана.
· Эффективность прохождения реагентов вдоль мембраны.
Эффективность прохождения реагентов вдоль мембраны напрямую обусловлена смачиваемостью мембраны. Количество ПАВ следует выбирать так, чтобы оптимизировать параметры сорбции реагентов по мембране и ширину окрашенной полосы, которая будет сохраняться на протяжении всего анализа.
· Ширина полосы.
Увеличение количества ПАВ на мембране может приводить к уширению тестовой линии, что в свою очередь может приводить к снижению интенсивности наблюдаемого сигнала и потери чувствительности анализа.
При введении ПАВ в реакционный раствор следует помнить, что также возможно вымывание уже присутствующих добавок в мембране, что приведет к изменению смачиваемости и других характеристик.
Мембрана для нанесения образца.
Основными задачами мембраны для нанесения образца являются обеспечение продвижения и равномерное распределение образца на мембране с конъюгатом и аналитической мембране. Мембрана может быть пропитана белками, детергентами, усилителями вязкости и буферными солями, что позволяет влиять на скорость потока образца. Цель этих добавок может состоять в увеличении вязкости образца, увеличении времени реакции на мембране с конъюгатом или даже химической модификации образца для связывания на тестовой линии.
Материал мембраны часто выбирается заранее в соответствии с целью испытания и свойствами образца. На данный момент существует два различных типа мембран для нанесения образца: тканая и целлюлозная [5, 7].
Тканая сетка используется для равномерного распределения образца по мембране с конъюгатом. Эти мембраны достаточно дороги, обладают большой механической прочностью, но малым удерживаемым объемом жидкости по сравнению с целлюлозными мембранами, что делает невозможным введение в них различного рода добавок.
Целлюлозные мембраны значительно дешевле, обладают малой механической прочностью, но большим объемом удерживаемой жидкости, однако их можно дополнительно обработать, что позволяет, например, уменьшить неспецифическое связывание, контролировать условия среды протекания реакции. Именно этот тип мембран для нанесения образца чаще всего используется для быстрого анализа.
Мембрана для нанесения конъюгата.
Целью этой мембраны является равномерный перенос образца и конъюгата к аналитической мембране.
В идеале мембрана должна обладать следующими свойствами [7]:
· низким неспецифическим связыванием, чтобы весь аналит из образца перешел на аналитическую мембрану;
· равномерной скоростью течения жидкости для обеспечения равномерного анализа;
· постоянным и равномерным распределением свободного объема по мембране, т.к. количество переносимого конъюгата, находящегося на мембране после его нанесения, должно быть одинаковым для различных образцов;
· низкой экстрагируемостью из мембраны по отношению к химическим примесям в мембране и механическим включениям;
· хорошей операционной стабильностью.
Материалом для мембраны послужили нетканые тонкослойные фильтры, характеризующиеся величиной волокон, толщиной, удельным весом, экстрагируемостью и скоростью прохождения воздушного потока.
Впитывающая (абсорбирующая) мембрана.
Основной функцией этой мембраны является увеличение объема жидкости, проходящей через аналитическую мембрану, что приводит к увеличению чувствительности метода. Материалом для мембраны чаще всего служат целлюлозные фильтры [7].
 2020-08-05
2020-08-05 673
673







