Метка играет огромную роль в быстрых иммунохроматографических анализах, поскольку с ее помощью можно оценить результат визуально, не прибегая к дополнительным процедурам или использованию специального оборудования.
Идеальная метка для анализа должна [5]:
· регистрироваться несколькими методами или технологиями в очень большом диапазоне;
· просто и эффективно связываться с биологическими веществами в конъюгаты без потери химической и биологической активности;
· обладать низким или вообще не обладать неспецифическим взаимодействием, то есть отношение сигнал/шум в многокомпонентных системах должно быть наибольшим;
· быть устойчивой в данных химических условиях анализа и при данной температуре;
· быть коммерчески доступной, иметь низкую стоимость;
· легко переносится потоком жидкости;
· быть способной к использованию для обнаружения нескольких аналитов.
Тем не менее, идеальной метки, которая удовлетворяла бы всем вышеперечисленным условиям, не существует. На данный момент наиболее распространенными метками являются следующие варианты.
Липосомы.
Липосомы представляют собой везикулы (пузырьки), сформированные из липидного бислоя. Ввиду их способности инкапсулировать высокие концентрации сигнальных молекул в своих ядрах [[8]], чувствительность теста может быть увеличена на 2-3 порядка.
В зависимости от используемого метода и требуемой чувствительности теста, размер липосом может колебаться от 50 до 800 нм. Кроме того, на липидную поверхность могут быть нанесены разные химически активные вещества, например, антитела или ферменты [[9]].
Основным недостатком липосом является относительная нестабильность и возможность лизиса из-за присутствия поверхностно-активных веществ. Другой проблемой является недостаток знаний в области высушивания и последующего восстановления липосом, что затрудняет коммерциализацию метода.
Коллоидный углерод.
Первое сообщение об использовании коллоидных частиц углерода появилось в 1993 году [[10]].
Преимуществами использования коллоидного углерода в качестве метки являются хорошая стабильность, дешевизна и доступность, а серо-черный цвет метки позволяет легко обрабатывать результаты для количественной оценки [[11]]. Также с коллоидным углеродом довольно легко можно получать конюъгаты с биомолекулами, однако, в отличие от коллоидного золота для этого требуется несколько больше времени – от одного до нескольких часов.
Несмотря на то, что коллоидные наночастицы золота наиболее часто используются в качестве метки, в некоторых работах углеродные наночастицы позволяют достичь меньших пределов обнаружения [[12]].
Флуоресцентные метки.
В качестве флуоресцентных меток чаще всего используют ксантеновые красители (флуоресцеин, техасский красный) и длинноволновые циановые красители (Су). Другой класс флуоресцентных меток – комплексы лантанидов [[13]]. Они уступают в яркости другим флуоресцентным меткам, но имеют очень большой Стоксов сдвиг. Время жизни у них также больше, чем у других меток, что позволяет разрабатывать чувствительные анализы с временным разрешением. Типичными представителями комплексов лантанидов являются комплексы европия, тербия и рутения, как, например, в работе [[14]].
Квантовые точки.
Квантовые точки это еще один класс флуоресцентных меток, которые представляют собой нанокристаллы или полупроводниковые нанокристаллы, обычно состоящие из CdSe, CdS, ZnSe, InP, InAs или слоя AnS (CdS) на ядре CdSe.
Когда полупроводник поглощает фотон, имеющий энергию большую, чем ширина запрещенной зоны, электрон перемещается с валентной зоны в проводящую, оставляя положительно заряженную дырку. Пара электрон–дырка называется экситоном. Экситон напоминает искусственный атом, имеющий радиус 1-10 нм, который зависит от свойств полупроводника. С уменьшением размера кристалла экситон все больше напоминает частицу в коробке. Его энергетические уровни в значительной степени определяются размером частицы (коробки) нежели свойствами полупроводника [[15]]. Полупроводниковые нанокристаллы, которые проявляют сильное квантовое удержание во всех трех измерениях, называют квантовыми точками. В результате рекомбинации электрона и дырки наблюдается свечение, длина волны которого зависит от размера частицы и разницы энергий проводящей и валентной зоны – чем больше разность энергий, тем больше смещение в сторону голубого цвета, чем меньше, тем больше смещение в сторону красного цвета [[16]]. Можно сделать квантовые точки одинакового размера, которые будут иметь узкие полосы испускания излучения, шириной в районе 10-50 нм.
Желательно, чтобы квантовые точки обладали следующими характеристиками [5]:
· сильной флуоресценцией с квантовым выходом больше 0,5;
· устойчивостью к фотообесцвечиванию;
· возможностью получения коллоидных суспензий с узким спектром излучения;
· возможность варьирования размера наночастиц в процессе производства для получения флуоресценции различных цветов;
· коммерческой доступностью.
В работе [[17]] разработали иммунохроматографический тест для одновременного определения в молоке трёх антибиотиков стрептомицина, хлорамфеникола и офлоксацина в формате так называемого «светофора». В качестве меток использовали квантовые точки с разными пиками эмиссии (525, 585 и 625 нм), что позволило в тестовой зоне наблюдать окрашенные полосы зелёного, жёлтого и красного цвета, соответственно.
Биолюминесцентные маркеры.
Перспективной люминесцентной меткой является рекомбинантный белок экворин. Белок был впервые выделен из медузы Aequorea Victoria. При активации ионами кальция экворин испускает свет в результате межмолекулярной реакции, в которой коэлентеразин (имидапиразиновое соединение не ковалентно связанное с белком) окисляется до коэлентарамида, испуская тем самым голубой свет с максимальной длиной волны 470 нм и образуя диоксид углерода. Количество выделяемого света пропорционально количеству активированного фотопротеина [[18]].
По мере прохождения анализируемой жидкости по полоске вначале аналит связывается с антителами, меченными экворином. После этого не вступивший в реакцию конъюгат антитело-экворин связывается с иммобилизованным в зоне «захвата» аналитом, а образовавшийся ранее иммунохимический комплекс проходит далее, попадая в третью зону, где иммобилизованы ионы кальция. В этой зоне происходит активация экворина, а излучаемый свет регистрируется фотоприемником [[19]].
Парамагнитные частицы.
Парамагнитные частицы это наночастицы оксида железа, которые становятся магнитными только при внесении их в магнитное поле. Эти коллоидные частицы могут быть покрыты полимерным покрытием, на котором могут адсорбироваться или связываться с ним ковалентно антитела и антигены. Такие конъюгаты применяют также как в случае использования коллоидного золота в качестве метки. Регистрируемым сигналом является магнитный поток, измеряемый при помещении парамагнитных частиц в магнитное поле.
Среди преимуществ использования данных частиц в качестве меток выделяют следующие: низкий уровень шума ввиду отсутствия магнетизма у аналита и биологического материала, стабильный и не исчезающий во времени сигнал, который можно измерить повторно при необходимости [[20], [21]], а также возможность модифицировать поверхность наночастицы [[22]].
Латексные частицы.
Латексные частицы первыми использовались в иммуноанализе в качестве метки. Они широкодоступны и относительно дешевы. Основным материалом для них служит стирол или его производные. Обычно латексные частицы содержат функциональные группы, способные ковалентно связывать антитела или антигены. Кроме того в них можно встраивать флуоресцентные красители, получая окрашенные латексы, которые нашли коммерческое применение [[23]]. Отсюда вытекает существенное преимущество латексных частиц – их можно детектировать несколькими способами сразу, например, парамагнитные частицы способны флуоресцировать и они при этом являются окрашенными
Коллоидное золото.
Возможно, что сегодня коллоидное золото наиболее часто используется в качестве метки в иммунохроматографическом анализе. На это есть несколько причин. Во-первых, оно является недорогим, во-вторых, легко и быстро готовится в лаборатории, в-третьих, коллоидное золото имеет интенсивную окраску и не требует дополнительных процессов для его визуализации [[24]]. Помимо этого существует огромное количество литературы, посвященной использованию коллоидного золота в качестве метки. Сама метка является стабильной в жидкости и в сухом виде. В дополнение к перечисленному, коллоидное золото как в форме метки, так и в форме конъюгатов с иммунореагентами коммерчески доступно. В ИХА, как правило, используются НЧЗ с диаметром 15-40 нм.
Коллоидную частицу золота можно представить условно в виде мицеллы [[25]]:
{[Au] m | n (AuCl4-)(n – x)H+| x H+|} x -,
Мицелла золота состоит из кристаллического ядра [Au] m, на поверхности которого адсорбированы ионы AuCl4-, которые определяют отрицательный заряд частицы. Кроме этого ионы AuCl4- составляют внутренний слой двойного электрического слоя и определяют величину потенциала адсорбции. Ионы Н+ находятся в интермицеллярном растворе. Наночастицы золота обладают уникальными оптическими свойствами, в частности явлением поверхностно плазмонного резонанса на длине волны 520 нм, который сдвигается в длинноволновую область с увеличением размера частиц.
В зависимости от условий получения, размеры синтезируемых наночастиц золота (НЧЗ) могут сильно отличаться друг от друга. Условно методы получения коллоидного золота можно разделить на дисперсионные (измельчение металла) и конденсационные (восстановление солей металла). Поскольку второй способ более распространен, остановимся на нем подробнее.
В основе методов синтеза НЧЗ лежит реакция химического восстановления соли золота Au3+ c образованием пересыщенного раствора молекулярного золота и последующего образования наночастиц золота. В качестве восстановителей применяют различные органические и неорганические вещества. В ранних работах по получению коллоидного золота в качестве восстановителя использовали этиловый спирт, белый фосфор и формальдегид. В настоящее время, используя эти восстановители, можно получать НЧЗ со средним диаметром 5-12 нм. Использование в качестве восстановителя боргидрида натрия позволяет получать частицы со средним диаметром 5 нм, тиоцианата натрия – 2-3 нм, этилендиаминтетрауксусной кислоты (ЭДТА) – около 20 нм [[26]]. Однако полученные этими методами золи золота обладают ограниченной стабильностью, а размер частиц сильно зависит от условий проведения реакции.
Стабильные монодисперсные наночастицы золота с диаметром 15-50 нм позволяет получить метод Френса [[27]], который является быстрым и простым в исполнении. В качестве восстановителя золотохлористоводородной кислоты используют цитрат натрия, реакция проводится при 100˚С.
Хлорамфеникол.
| Рис. 4. Структура ХАФ |
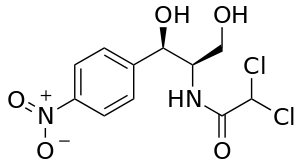 Хлорамфеникол (ХАФ) или левомицетин является антибиотиком широкого спектра действия. Название по ИЮПАК: D-(-) – трео -1-(n -нитрофенил)-2дихлор-ацетиламино-1,3-пропандиол (рис. 4). Он активен к грамположительным и грамотрицательным бактериям, а также к штаммам, устойчивым к пенициллину, стрептомицину, сульфаниламидам. Устойчивость микроорганизмов к хлорамфениколу вырабатывается медленно [3]. ХАФ был одним из первых антибиотиков, которые стали получать синтетически в промышленных масштабах.
Хлорамфеникол (ХАФ) или левомицетин является антибиотиком широкого спектра действия. Название по ИЮПАК: D-(-) – трео -1-(n -нитрофенил)-2дихлор-ацетиламино-1,3-пропандиол (рис. 4). Он активен к грамположительным и грамотрицательным бактериям, а также к штаммам, устойчивым к пенициллину, стрептомицину, сульфаниламидам. Устойчивость микроорганизмов к хлорамфениколу вырабатывается медленно [3]. ХАФ был одним из первых антибиотиков, которые стали получать синтетически в промышленных масштабах.
ХАФ используют для лечения таких заболеваний, как менингит, холера, чума, брюшной тиф, конъюнктивит. В настоящее время он сравнительно мало используется в медицине, поскольку имеет множество побочных эффектов, таких как апластическая анемия, лейкемия, угнетение головного мозга. Также у людей, принимающих данный антибиотик, были описаны головная боль, легкая депрессия, спутанность сознания и делирий. Ввиду этого ХАФ используется только в случаях, когда нет альтернативы.
В настоящее время хлорамфеникол иногда используется в животноводстве для лечения ряда заболеваний или в качестве профилактического средства. Однако ввиду того, что ХАФ легко растворяется в жирах и всасывается в кровь, через продукты животного происхождения, например, молоко, яйца, мёд и другие этот антибиотик может попадать в организм человека и накапливаться в нем. На человека это может оказывать токсический эффект, чаще всего в виде возникновения аллергических реакций, дисбактериозов и других неблагоприятных явлений. В связи с этим ряд стран, в том числе страны Европейского союза и Россия, не допускают или строго ограничивают наличие хлорамфеникола в продуктах питания, а для методов его определения был установлен критерий «Minimum Required Performance Limit» (MRPL), согласно которому минимальная определяемая с помощью данной методики концентрация должна быть не больше 0,3 нг/мл (0,3 мкг/кг) [[28],[29]].
 2020-08-05
2020-08-05 624
624








