Основные определения
Сообщение телу теплоты в каком-либо процессе вызывает изменение его состояния и в общем случае сопровождается изменением температуры. Отношение теплоты dq, полученное единицей количества вещества при бесконечно малом изменении его состояния, к изменению температуры dt называется удельной теплоемкостью тела в данном процессе:
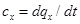 . (5.1)
. (5.1)
Величина q в уравнении (5.1) зависит не только от интервала температур, но и от вида процесса подвода теплоты, характеризуемого некоторым постоянным параметром х, которым может быть объем тела υ, давление р и др. Общее количество теплоты, полученное в данном процессе, определяется выражением
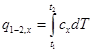 . (5.2)
. (5.2)
Поскольку количество теплоты dq1-2,x зависит от характера процесса, то и теплоемкость системы сх зависит от условий протекания процесса.
Массовая, объемная и мольная теплоемкости газов
В термодинамике различают теплоемкости: массовую, объемную и мольную.
Теплоемкость, отнесенную к 1 кг газа, называют массовой и обозначают сх. Измеряют эту теплоемкость в кДж/(кг • град).
Теплоемкость, отнесенную к 1 м3 газа при нормальных физических условиях, т. е. при давлении 101325 Н/м2 и температуре 0° С, называют объемной и обозначают буквой с'х; измеряют ее в кДж/(м3 • град).
Теплоемкость, отнесенную к 1 кмоль газа, называют мольной и обозначают μсх; измеряют ее в кДж/(кмоль·град).
Между указанными теплоемкостями существует следующая связь:
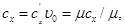 (5.3)
(5.3)
где υ0 — удельный объем при нормальных термодинамических условиях; μ — молекулярная масса.
 2020-08-05
2020-08-05 300
300








