Билет №1
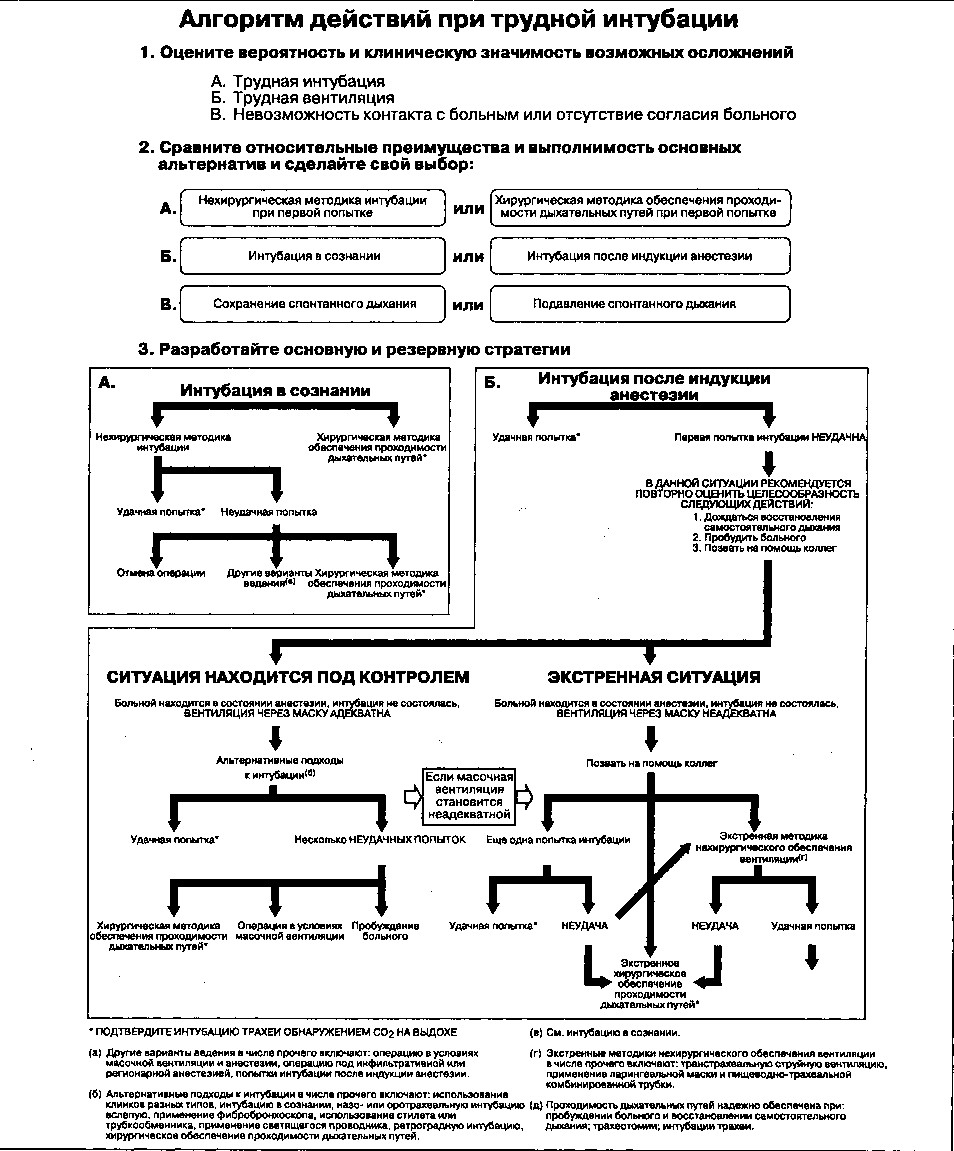
1.Особенности предоперационной оценки дыхательных путей. Алгоритмы действий при трудных дыхательных путях.
2. Техника установки катетера в центральную вену. (өздерің білесіңдер)
Билет№ 2
1.Кетоацидотическая и гипергликемическая кома.
Гипергликемическая кома – это патологическое состояние, которое развивается у страдающих сахарным диабетом при недостатке инсулина. В крови при этом резко увеличивается концентрация глюкозы и накапливаются токсические продукты обмена веществ.
Признаки
При повышении концентрации глюкозы в крови человек ощущает постепенно нарастающую слабость, сонливость, жажду. Аппетит теряется, а вот в туалет, напротив, хочется все чаще. Дыхание также учащается.
Через некоторое время человек теряет сознание. Артериальное давление при этом низкое, кожная чувствительность снижена, конечности подергиваются. Характерный признак гипергликемической комы – запах ацетона изо рта. При надавливании глазные яблоки мягкие. Конечности могут подергиваться.
Гипергликемическая кома развивается, если человек, страдающий сахарным диабетом:
- не соблюдает график введения и дозировку инсулина, вводит его слишком редко или слишком мало;
- не вводит инсулин;
- не знает о начавшемся заболевании;
- не соблюдает диету;
- получил травму;
- заразился инфекционным заболеванием.
Кроме того, диабетическая кома может развиться при беременности или после оперативного вмешательства.
В этих случаях возникает недостаточность инсулина и организм не может усваивать глюкозу. В результате нарушается реабсорбция воды в почках, увеличивается выработка мочи, организм обезвоживается, кровьсгущается, могут образовываться тромбы. При этом человек много пьет, однако этого количества поступающие воды мало для восстановления водного баланса. Постепенно человек слабеет, потом у него развивается заторможенность, и через некоторое время он теряет сознание. Это гиперосмолярная кома, она чаще встречается у страдающих диабетом второго типа. Это состояние часто бывает у пожилых людей или у перенесших инфекционное заболевание.
А клеткам тем временем необходимо «топливо», в качестве его источника организм использует жиры. В процессе их переработки образуются кетоновые тела. Именно из-за них у человека в гипергликемической коме обнаруживается запах ацетона изо рта. Излишек кетонов в организме, кетоацидоз, проявляется жаждой, сухостью кожи и слизистых оболочек, сонливостью и головной болью. Иногда возможны тошнота и рвота. Если причиной комы стали кетоновые тела, ее называют кетоациотической. Она чаще развивается у страдающих диабетом первого типа.
Первая помощь
На ранних стадиях гипергликемической комы человеку может помочь инъекция инсулина. Щелочная минеральная вода поможет нейтрализовать ацидоз, а препараты калия и магния помогут восстановить электролитный баланс.
Однако если пациент уже в коме или в состоянии, близком к коме, необходимо немедленно вызвать «Скорую». А до ее приезда нужно уложить человека на бок чтобы предотвратить западание языка и обеспечить ему нормальный приток воздуха.
Диагностика
Для постановки диагноза «гипергликемическая кома» делают анализ уровня глюкозы в крови. Также делают электрокардиографию и пульсоксиметрию.
Для дифференцирования с гипогликемической комой вводят внутривенно 10-20 мл 40 % раствора глюкозы. Человеку в гипергликемической коме это количество глюкозы не нанесет большого вреда, а состояние человека в гипогликемической коме значительно улучшится.
Лечение
Пациентов в предкоматозном и коматозном состоянии госпитализируют в стационар в отделение реанимации. Там восстанавливают уровень инсулина и избавляются от последствий недостатка этого гормона.
Кроме того, восстанавливают объем крови и электролитный баланс – вводят внутривенно растворы электролитов.
Через несколько дней, когда пациенту становится лучше, его переводят в эндокринологическое отделение.
Если квалифицированная помощь была оказана на начальных этапах комы, возможно полное восстановление пациента. В противном случае пациент может погибнуть. Летальность при гипергликемической коме примерно 10 %.
Профилактика
Для профилактики гипергликемической комы диабетикам нужно постоянно контролировать уровень глюкозы в крови, строго придерживаться диеты, своевременно вводить инсулин, следить за его сроком годности. Важно своевременно лечить инфекционные заболевания, избегать стрессов и больших физических нагрузок, предохраняться от травм.
Здоровые люди должны периодически контролировать уровень сахара в крови. При его повышении обязательно нужно обратиться к эндокринологу.
2. Спинальная анестезия, сущность методов, сравнительная их оценка, показания к применению, возможные осложнения, их профилактика и лечение.
Спинномозговая анестезия заключается в инъекции раствора местного анестетика в субарахнои-дальное пространство спинного мозга. Со времени первоначального описания в 1899 г. Августом Би-ром спинномозговая анестезия изведала и периоды значительной популярности, и забвение. Активно применяться методика стала с появлением новых местных анестетиков, усовершенствованных пункционных игл, а также благодаря выявлению возможных осложнений и разработке мер их профилактики. Эпидемиологические исследования, проведенные Дриппсом в начале 1960-х гг., продемонстрировали безопасность спинномозговой анестезии для нервной системы и способствовали широкому распространению этого метода.
Показания
Спинномозговая анестезия используется при оперативных вмешательствах на нижних конечностях, тазобедренном суставе, промежности, нижнем этаже брюшной полости и поясничном отделе позвоночника. Возможно применение данной методики и при вмешательствах на верхних этажах брюшной полости, например при холецистэкто-мии и резекции желудка, но при этом необходима блокада высокого уровня. К сожалению, многие больные, для которых этот метод анестезии был бы наиболее эффективным, не переносят высокий уровень блокады из-за сопутствующей медикаментозной симпатэктомии. При выполнении больших операций на органах брюшной полости у больных с сохраненным сознанием необходимо прибегать к осторожной, щадящей хирургической технике, так как грубые манипуляции могут вызвать ощущение выраженного дискомфорта даже при глубокой блокаде. В подобных случаях спинномозговую анестезию можно сочетать с поверхностной общей анестезией и, возможно, с интратекальным введением опиоидов. Рассмотрим некоторые показания к спинномозговой анестезии.
Осложнения. Спинномозговая анестезия может сопровождаться как незначительными (боль во время пункции, боль в спине, задержка мочи), так и серьезными (менингит, поперечный миелит, синдром передних рогов спинного мозга, тотальная спинномозговая анестезия) осложнениями.
Боль во время пункции. Несмотря на тщательное обезболивание кожи и подлежащих структур, многие больные испытывают дискомфорт во время введения пункционной иглы. Особенно часто боль возникает при сопутствующих заболеваниях и дегенеративных изменениях позвоночника, после операций. Даже больные, заранее предупрежденные о возможном дискомфорте, могут нуждаться в дополнительной аналгезии или седации.
Боль в спине. Боль в спине может быть осложнением спинномозговой пункции. Введение иглы вызывает локальную гиперемию, раздражение тканей, рефлекторный спазм мышц. В результате возникают боли, которые сохраняются не более 10-14 дней даже при использовании игл большого размера, которые применяются при эпидуральной и длительной спинномозговой анестезии. Больные с грыжами межпозвоночных дисков имеют все основания перед операцией спросить у анестезиолога, не усугубит ли спинномозговая анестезия хронической боли в спине. Несмотря на отсутствие доказательств того, что спинномозговая анестезия провоцирует обострение при грыже диска или хронической боли в спине, нельзя гарантировать, что спинномозговая анестезия не усилит боли в послеоперационном периоде. Из опыта известно, что когда у таких больных после спинномозговой анестезии случается обострение болевого синдрома, то оно кратковременное и не очень тяжелое, но этого опять-таки нельзя гарантировать. Если пациенту ранее уже производились вмешательства на поясничном отделе позвоночника, то технические трудности при пункции будут особенно значительными, так что можно прогнозировать развитие выраженного дискомфорта и рефлекторного мышечного спазма.
Головная боль. Постпункционная головная боль, сочетанная со спинномозговой анестезией, обусловлена зияющим дефектом твердой мозговой оболочки, приводящим к истечению цереброспинальной жидкости в окружающие мягкие ткани и, соответственно, к снижению ее давления. Снижение давления цереброспинальной жидкости приводит к смещению вниз структур ЦНС и сосудов, которые связывают твердую мозговую оболочку с черепом и стволом мозга. В результате возникает цефалгия, по характеру напоминающая острую сосудистую кластерную головную боль. Постуральная по природе, головная боль обычно начинается через 6-12 ч после пункции и усиливается в вертикальном положении. Для нее свойственны пульсирующий характер, локализация в лобной области, сочетание с тошнотой и рвотой и незамедлительное ослабление при переходе в горизонтальное положение. Обычно цефал-гии возникают через 6-12 ч после операции, когда больной начинает садиться или вставать. Самым важным фактором, который влияет на развитие постпункционных головных болей, является размер пункционной иглы: чем больше размер иглы, тем выше риск возникновения болей и выраженнее их интенсивность. Для спинномозговой анестезии используют иглы размером 22-30 G.
Расположение среза иглы во время пункции тоже влияет на возникновение головной боли. Волокна твердой мозговой оболочки ориентированы в продольном направлении, поэтому считают, что если срез иглы во время пункции параллелен волокнам, то они смещаются в стороны, а не рассекаются. Разработаны специальные иглы, меньше повреждающие твердую мозговую оболочку, например иглы Грини и Уайтэкра.
Появление головных болей также зависит от возраста и пола пациентов: у пожилых людей и мужчин риск ниже. Наоборот, при беременности высокое внутрибрюшное давление способствует повышению давления цереброспинальной жидкости и истечению ликвора, что увеличивает распространенность головных болей у больных этой группы.
Консервативное лечение постпункционной головной боли в течение первых 24 ч включает интенсивный прием жидкости (или в/в инфузию); диету с исключением твердой пищи; слабительные, способствующие размягчению каловых масс; анальге-тики внутрь, бандаж-набрюшник. Если эти меры неэффективны, можно предпринять эпидуральное пломбирование кровью. Иглу для эпидуральной пункции вводят в тот же межпозвоночный промежуток, где была выполнена пункция твердой мозговой оболочки. При строгом соблюдении асептики из вены больного берут 15 мл крови и вводят через иглу в эпидуральное пространство, пока больной не ощутит давления в ушах или не будет введен весь указанный объем. После первой попытки эпиду-ралъного пломбирования кровью постпункционная головная болъ полностью проходит у 95 % больных (при условии, что пломбирование выполнено не ранее чем через 24 ч после пункции твердой мозговой оболочки). Предполагают, что при эпидуральном пломбировании шероховатая поверхность разрыва в твердой мозговой оболочке служит местом адге-зии тромбоцитов с последующим формированием сгустка, который обтурирует дефект и препятствует истечению цереброспинальной жидкости. Если при первой процедуре не удалось устранить головную боль, то вероятность успеха при второй попытке еще выше — до 99 %. Осложнения эпидурального пломбирования носят преходящий характер и включают боль во время пункции эпидурального пространства piспазм мышц, сочетанный с введением крови. Гораздо реже возникают менингеальные симптомы, обусловленные миграцией крови в суб-арахноидальное пространство.
Новый метод лечения постпункционной головной боли состоит в назначении кофеина внутрь или в/в. Кофеин — это мощный вазоконстриктор, его присутствие в кровотоке препятствует тракции сосудов и последующему их спазму. Быстрая в/в инфузия 500 мг кофеина, разведенного в 1 л изотонического кристаллоидного раствора, позволяет одномоментно решить две задачи: ввести жидкость для обеспечения необходимого объема ликвора и устранить сосудистый спазм. В отличие от эпидурального пломбирования во многих случаях кофеин устраняет головную боль только на время.
Осложнения. Спинномозговая анестезия может сопровождаться как незначительными (боль во время пункции, боль в спине, задержка мочи), так и серьезными (менингит, поперечный миелит, синдром передних рогов спинного мозга, тотальная спинномозговая анестезия) осложнениями.
Боль во время пункции. Несмотря на тщательное обезболивание кожи и подлежащих структур, многие больные испытывают дискомфорт во время введения пункционной иглы. Особенно часто боль возникает при сопутствующих заболеваниях и дегенеративных изменениях позвоночника, после операций. Даже больные, заранее предупрежденные о возможном дискомфорте, могут нуждаться в дополнительной аналгезии или седации.
Боль в спине. Боль в спине может быть осложнением спинномозговой пункции. Введение иглы вызывает локальную гиперемию, раздражение тканей, рефлекторный спазм мышц. В результате возникают боли, которые сохраняются не более 10-14 дней даже при использовании игл большого размера, которые применяются при эпидуральной и длительной спинномозговой анестезии. Больные с грыжами межпозвоночных дисков имеют все основания перед операцией спросить у анестезиолога, не усугубит ли спинномозговая анестезия хронической боли в спине. Несмотря на отсутствие доказательств того, что спинномозговая анестезия провоцирует обострение при грыже диска или хронической боли в спине, нельзя гарантировать, что спинномозговая анестезия не усилит боли в послеоперационном периоде. Из опыта известно, что когда у таких больных после спинномозговой анестезии случается обострение болевого синдрома, то оно кратковременное и не очень тяжелое, но этого опять-таки нельзя гарантировать. Если пациенту ранее уже производились вмешательства на поясничном отделе позвоночника, то технические трудности при пункции будут особенно значительными, так что можно прогнозировать развитие выраженного дискомфорта и рефлекторного мышечного спазма.
Головная боль. Постпункционная головная боль, сочетанная со спинномозговой анестезией, обусловлена зияющим дефектом твердой мозговой оболочки, приводящим к истечению цереброспинальной жидкости в окружающие мягкие ткани и, соответственно, к снижению ее давления. Снижение давления цереброспинальной жидкости приводит к смещению вниз структур ЦНС и сосудов, которые связывают твердую мозговую оболочку с черепом и стволом мозга. В результате возникает цефалгия, по характеру напоминающая острую сосудистую кластерную головную боль. Постуральная по природе, головная боль обычно начинается через 6-12 ч после пункции и усиливается в вертикальном положении. Для нее свойственны пульсирующий характер, локализация в лобной области, сочетание с тошнотой и рвотой и незамедлительное ослабление при переходе в горизонтальное положение. Обычно цефал-гии возникают через 6-12 ч после операции, когда больной начинает садиться или вставать. Самым важным фактором, который влияет на развитие постпункционных головных болей, является размер пункционной иглы: чем больше размер иглы, тем выше риск возникновения болей и выраженнее их интенсивность. Для спинномозговой анестезии используют иглы размером 22-30 G.
Расположение среза иглы во время пункции тоже влияет на возникновение головной боли. Волокна твердой мозговой оболочки ориентированы в продольном направлении, поэтому считают, что если срез иглы во время пункции параллелен волокнам, то они смещаются в стороны, а не рассекаются. Разработаны специальные иглы, меньше повреждающие твердую мозговую оболочку, например иглы Грини и Уайтэкра.
Появление головных болей также зависит от возраста и пола пациентов: у пожилых людей и мужчин риск ниже. Наоборот, при беременности высокое внутрибрюшное давление способствует повышению давления цереброспинальной жидкости и истечению ликвора, что увеличивает распространенность головных болей у больных этой группы.
Консервативное лечение постпункционной головной боли в течение первых 24 ч включает интенсивный прием жидкости (или в/в инфузию); диету с исключением твердой пищи; слабительные, способствующие размягчению каловых масс; анальге-тики внутрь, бандаж-набрюшник. Если эти меры неэффективны, можно предпринять эпидуральное пломбирование кровью. Иглу для эпидуральной пункции вводят в тот же межпозвоночный промежуток, где была выполнена пункция твердой мозговой оболочки. При строгом соблюдении асептики из вены больного берут 15 мл крови и вводят через иглу в эпидуральное пространство, пока больной не ощутит давления в ушах или не будет введен весь указанный объем. После первой попытки эпиду-ралъного пломбирования кровью постпункционная головная болъ полностью проходит у 95 % больных (при условии, что пломбирование выполнено не ранее чем через 24 ч после пункции твердой мозговой оболочки). Предполагают, что при эпидуральном пломбировании шероховатая поверхность разрыва в твердой мозговой оболочке служит местом адге-зии тромбоцитов с последующим формированием сгустка, который обтурирует дефект и препятствует истечению цереброспинальной жидкости. Если при первой процедуре не удалось устранить головную боль, то вероятность успеха при второй попытке еще выше — до 99 %. Осложнения эпидурального пломбирования носят преходящий характер и включают боль во время пункции эпидурального пространства piспазм мышц, сочетанный с введением крови. Гораздо реже возникают менингеальные симптомы, обусловленные миграцией крови в суб-арахноидальное пространство.
Новый метод лечения постпункционной головной боли состоит в назначении кофеина внутрь или в/в. Кофеин — это мощный вазоконстриктор, его присутствие в кровотоке препятствует тракции сосудов и последующему их спазму. Быстрая в/в инфузия 500 мг кофеина, разведенного в 1 л изотонического кристаллоидного раствора, позволяет одномоментно решить две задачи: ввести жидкость для обеспечения необходимого объема ликвора и устранить сосудистый спазм. В отличие от эпидурального пломбирования во многих случаях кофеин устраняет головную боль только на время.
Билет №3
1.Острое повреждение легких и респираторный дистресс-синдром взрослых: причины, патогенез, клиника, диагностика, принципы интенсивной терапии.
Острый респираторный дистресс-синдром (ОРДС, респираторный дистресс-синдром взрослых (РДСВ)) — жизнеугрожающее воспалительное поражение лёгких, характеризующееся диффузной инфильтрацией и тяжёлой гипоксемией. Данное патологическое состояние вызывается множеством причин, которые напрямую или косвенно поражают лёгкие. ОРДС часто приводит к смерти, требует проведения интенсивной терапии и искусственной вентиляции лёгких.
Патогенез
В основе ОРДС лежит диффузное воспаление лёгких. В этом процессе выделяют 3 фазы: экссудативная, пролиферативная и фибротическая.
В экссудативную фазу в ответ на воспаление выделяются цитокины и другие провоспалительные вещества, которые активируют альвеолярные макрофаги и циркулирующие нейтрофилы. В свою очередь, активированные нейтрофилы прикрепляются к эндотелию лёгочных капилляров и высвобождают содержимое своих цитоплазматических гранул(протеазы и токсические метаболиты кислорода)[8]. Это приводит к повреждению эндотелия капилляров и эпителия альвеол, нарушая альвеолярно-капиллярный барьер. В результате экссудат проникает в лёгочную паренхиму и альвеолярное воздушное пространство. Нарушается газообмен и возникает гипоксия. Также возможно повреждение альвеолоцитов II типа, которые отвечают за образование сурфактанта. При этом происходит спадение альвеол, снижение растяжимости лёгких и внутрилёгочное шунтирование. Кроме того, развивается лёгочная гипертензия в результате внутрисосудистой обструкции тромбами, спазма лёгочных сосудов из-за гипоксии и действия некоторых воспалительных медиаторов (тромбоксан, лейкотриены и эндотелин).
В пролиферативную фазу у большинства пациентов происходит восстановление лёгких: удаляется экссудат, нейтрофильная инфильтрация сменяется лимфоцитарной. Пролиферируют альвеолоциты II типа, которые образуют новый сурфактант и дифференцируются в альвеолоциты I типа. Но несмотря на такие улучшения, у многих больных сохраняется одышка, тахипноэ, гипоксемия. У некоторых пациентов процесс переходит в фибротическую фазу. Накопленный в лёгких фибрин подвергается ремоделированию и может вызывать фиброз[11].
Клиническая картина
ОРДС чаще возникает в первые 12—48 часов от начала основного заболевания (в некоторых случаях через 5—7 дней). Больной может жаловаться наодышку, дискомфорт в грудной клетке, сухой кашель. При его осмотре выявляют тахипноэ, тахикардию, участие вспомогательных мышц в дыхании, цианозкожного покрова. При аускультации можно выявить двусторонние хрипы.
Диагностика
ОПЛ (острое повреждение лёгких) — более лёгкая форма ОРДС; PaO2 — парциальное давление кислорода в артериальной крови (мм рт. ст.); FiO2 (англ.)русск. — фракционная концентрация кислорода во вдыхаемом газе (десятичной дробью, например 0,5)
Обнаруживают прогрессирующую гипоксемию (SpO2 (англ.)русск. ниже 90 %), которая часто рефрактерна к ингаляциям кислорода. При исследовании газов артериальной крови на начальных стадиях ОРДС выявляют низкое PaO2, нормальное или низкое РаСО2 и повышение рН (алкалоз). В последующем РаСО2 нарастает и алкалоз сменяется ацидозом.
При рентгенографии лёгких видны двусторонние диффузные инфильтраты, иногда — плевральный выпот. Такие признаки неспецифичны и также характерны для кардиогенного отёка лёгких, что затрудняет дифференциальную диагностику. Компьютерная томография показывает негомогенную инфильтрацию лёгких в определённых отделах (в задненижних отделах у лежачих больных). Это объясняется зависимым от силы тяжести распределением отёка лёгких и сдавлением вышележащими отёчными отделами лёгких.
Бронхоальвеолярный лаваж — наиболее надёжный метод диагностики ОРДС. При этом вводят гибкий фибробронхоскоп в один из поражённых сегментов лёгких. Затем промывают лёгочный сегмент изотоническим раствором и анализируют состав промывной жидкости. У больных с ОРДС обнаруживают нейтрофилы, составляющие 60—80 % всех клеток промывной жидкости (в норме < 5 %).
Лечение
Лечение в первую очередь направлено на устранение заболевания, приведшего к ОРДС. Если это невозможно (например, после массивных переливаний крови, аортокоронарного шунтирования и т.д.), то ограничиваются поддерживающей терапией,
 2020-08-05
2020-08-05 101
101







