Поджелудочная железа является уникальным органом человеческого организма, ведь вещества, которые она вырабатывает, участвуют в процессах пищеварения и усвоения питательных веществ, практически на всех этапах. Большая часть клеток этого органа вырабатывает сложный по составу пищеварительный сок, без ферментов которого невозможны процессы пищеварения в тонком кишечнике. Относительно небольшое количество клеток секретирует в кровь гормоны инсулин и глюкагон, которые участвуют в обмене углеродов и регуляции метаболических процессов практически во всех клетках организма, а также схожее по структуре с гормонами вещество липокаин, участвующее в регуляции некоторых биохимических процессах, происходящих в печени.
В составе панкреатического сока, который вырабатывается внешнесекреторными клетками поджелудочной железы, кроме жидкой его составляющей, есть небольшое количество слизи и ферменты, которые непосредственно участвуют в процессе переваривания пищи. К особенностям работы поджелудочной железы можно отнести тот факт, что некоторые ферментативные вещества, которые образуются в клетках, первоначально синтезируются в неактивной форме и в таком виде выделяются в проток поджелудочной железы, через который они попадают в общий желчный проток и двенадцатиперстную кишку.
Только в просвете кишечника происходит активизация неактивных ферментов – в противном случае панкреатический сок, компоненты которого отличаются высокой активностью, немедленно после выделения начинали бы переваривание ткани органа. Для активизации ферментов панкреатического сока необходимо наличие в просвете двенадцатиперстной кишки достаточного количества желчи. Под влиянием желчи клетки слизистой начального отдела тонкого кишечника начинают вырабатывать фермент энтерокиназу, которая превращает неактивную форму фермента трипсиноген в активный трипсин, а этот фермент в свою очередь активизирует остальные компоненты панкреатического сока.
Трипсин. Трипсиноген и трипсин получены в кристаллическом виде, полностью расшифрована их первичная структура и известен молекулярный механизм превращения профермента в активный фермент. В опытах in vitro превращение трипсиногена в трипсин катализируют не только энтеро-пептидаза и сам трипсин, но и другие протеиназы и ионы Са2+.
Активирование трипсиногена химически выражается в отщеплении с N-конца полипептидной цепи 6 аминокислотных остатков (Вал–Асп– Асп–Асп–Асп–Лиз) и соответственно в укорочении полипептидной цепи (рис. 12.1).
Следует подчеркнуть, что в этом небольшом, казалось бы, химическом процессе – отщепление гексапептида от предшественника – заключено важное биологическое значение, поскольку при этом происходят формирование активного центра и образование трехмерной структуры трипсина, а известно (см. главы 1 и 4), что и белки биологически активны только в своей нативной трехмерной конформации. В том, что трипсин, как и другие протеиназы, вырабатывается в поджелудочной железе в неактивной форме, также имеется определенный физиологический смысл, поскольку в противном случае трипсин мог бы оказывать разрушающее протеолитическое действие не только на клетки самой железы, но и на другие ферменты, синтезируемые в ней (амилаза, липаза и др.). В то же время поджелудочная железа защищает себя еще одним механизмом – синтезом специфического белка ингибитора панкреатического трипсина. Этот ингибитор оказался
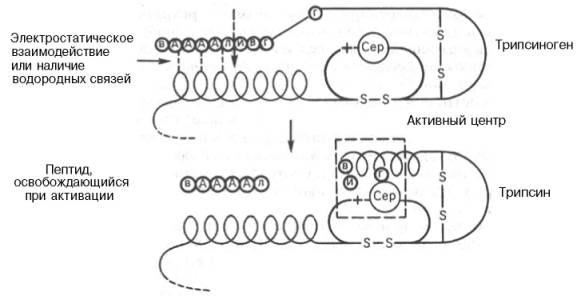
Рис. 12.1. Механизм активации трипсиногена быка (схема).
низкомолекулярным пептидом (мол. масса 6000), который прочно связывается с активными центрами трипсина и химотрипсина, вызывая обратимое их ингибирование. В поджелудочной железе синтезируется также α1-антипротеиназа (мол. масса 50000), которая преимущественно инги-бирует эластазу.
При остром панкреатите, когда трипсин и другие ферменты из пораженной поджелудочной железы «вымываются» в кровь, уровень их в крови соответствует размерам некротического участка. В этом случае определение активности трипсина в сыворотке крови является надежным ферментным тестом при диагностике острого панкреатита. Следует отметить, что субстратная специфичность трипсина ограничена разрывом только тех пептидных связей, в образовании которых участвуют карбоксильные группы лизина и аргинина.
Химотрипсин. В поджелудочной железе синтезируется ряд химотрип-синов (α-, β- и π-химотрипсины) из двух предшественников – химотрипси-ногена А и химотрипсиногена В. Активируются проферменты в кишечнике под действием активного трипсина и химотрипсина. Полностью раскрыта последовательность аминокислот химотрипсиногена А, во многом сходная с последовательностью аминокислот трипсина. Молекулярная масса его составляет примерно 25000. Он состоит из одной полипептидной цепи, содержащей 246 аминокислотных остатков. Активация профермента не сопряжена с отщеплением большого участка молекулы (см. рис. 4.3). Получены доказательства, что разрыв одной пептидной связи между аргинином и изолейцином в молекуле химотрипсиногена А под действием трипсина приводит к формированию π-химотрипсина, обладающего наибольшей ферментативной активностью. Последующее отщепление дипеп-тида Сер–Арг приводит к образованию δ-химотрипсина. Аутокаталити-ческий процесс активирования, вызванный химотрипсином, сначала способствует формированию неактивного промежуточного неохимотрипсина, который под действием активного трипсина превращается в α-химотрип-син; этот же продукт образуется из δ-химотрипсина, но под действием активного химотрипсина.
Таким образом, благодаря совместному перекрестному воздействию химотрипсина и трипсина из химотрипсиногена образуются разные химо-трипсины, различающиеся как ферментативной активностью, так и некоторыми физико-химическими свойствами, в частности электрофорети-ческой подвижностью.
Следует отметить, что химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только пептидов, но и эфиров, гидроксаматов, амидов и других ацилпроизводных, хотя наибольшую активность химотрипсин проявляет по отношению к пептидным связям, в образовании которых принимают участие карбоксильные группы ароматических аминокислот: фенилаланина, тирозина и триптофана.
Эластаза. В поджелудочной железе синтезируется еще одна эндопеп-тидаза – эластаза – в виде проэластазы. Превращение профермента в элас-тазу в тонкой кишке катализируется трипсином. Название фермент получил от субстрата эластина, который он гидролизует. Эластин содержится в соединительной ткани и характеризуется наличием большого числа остатков глицина и серина. Эластаза обладает широкой субстратной специфичностью, но предпочтительнее гидролизует пептидные связи, образованные аминокислотами с небольшими гидрофобными радикалами, в частности глицином, аланином и серином. Интересно, что ни трипсин, ни химотрипсин не гидролизуют пептидные связи молекулы эластина, хотя все три фермента, включая эластазу, содержат сходные участки аминокислотных последовательностей и одинаковые места положения дисульфидных мостиков, а также имеют в активном центре один и тот же ключевой остаток серина (см. табл. 4.2), что подтверждают опыты с ингибированием всех трех ферментов диизопропилфторфосфатом, химически связывающим ОН-группу серина. Высказано предположение, что все три эндопептидазы поджелудочной железы: трипсин, химотрипсин и эластаза,– возможно, имеют один и тот же общий предшественник и что специфичность активного фермента в основном определяется конформационными изменениями профермента в процессе активирования.
Экзопептидазы. В переваривании белков в тонкой кишке активное участие принимает семейство экзопептидаз. Одни из них – карбоксипеп-тидазы – синтезируются в поджелудочной железе в виде прокарбоксипеп-тидазы и активируются трипсином в кишечнике; другие – аминопептидазы – секретируются в клетках слизистой оболочки кишечника и также активируются трипсином.
Карбоксипептидазы. Подробно изучены две карбоксипептидазы – А и В, относящиеся к металлопротеинам и катализирующие отщепление от полипептида С-концевых аминокислот. Карбоксипептидаза А разрывает преимущественно пептидные связи, образованные концевыми ароматическими аминокислотами, а карбоксипептидаза В – связи, в образовании которых участвуют С-концевые лизин и аргинин. Очищенный препарат карбокси-пептидазы А обладает бифункциональной активностью – пептидазной и эстеразной и содержит ион Zn2+(один атом на 1 моль фермента). При замене ионов Zn2+на ионы Са2+ полностью утрачивается пепти-дазная активность, но усиливается исходная эстеразная активность, хотя при этом существенных изменений в третичной структуре фермента не отмечается.
 2020-08-05
2020-08-05 560
560








