I. Взаимодействие с простыми веществами.
1. При высокой температуре взаимодействует с кислородом: 2Cu + O2 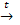 2CuO
2CuO
2. Взаимодействует с неметаллами при высоких температурах: Cu + Cl2 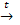 CuCl2
CuCl2
II. Взаимодействие со сложными веществами.
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑+ 2H2O
Cu + 2H2SO4(конц.) → CuSO4 + SO2↑+2H2O
Химические свойства железа
I. Взаимодействие с простыми веществами.
1. Горит в кислороде, образуя окалину - оксид железа (II, III): 3Fe + 2O2 → Fe3O4
2. Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2  2FeBr3
2FeBr3
Fe + S  FeS
FeS
II. Взаимодействие со сложными веществами.
1. При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O  Fe3O4 + 4H2 ↑
Fe3O4 + 4H2 ↑
2. На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О → 4Fе(ОН)3.
3. Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4(разб.) → FeSO4 + H2↑
4. В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
2Fe + 6H2SO4(конц.)  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.)  Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5. Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu↓
Химические свойства хрома
I. Взаимодействие с простыми веществами.
1. При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 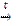 2Cr2O3
2Cr2O3
2Cr + 3Cl2 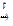 2CrCl3
2CrCl3
2Cr + N2 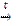 2CrN
2CrN
2Cr + 3S 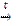 Cr2S3
Cr2S3
 2020-08-05
2020-08-05 289
289








