Подготовка к ЕГЭ-2016 по химии (задание 30)
Проверяемый элемент содержания:
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная

Одним из важнейших свойств солей является гидролиз. Гидролизом называют взаимодействие ионов соли с водой, приводящее к образованию слабого электролита.
В зависимости от силы кислот и оснований образуемые ими соли делят на четыре
типа:
1) соли, образованные катионом сильного основания и анионом сильной кислоты;
2) соли, образованные катионом сильного основания и анионом слабой кислоты;
3) соли, образованные катионом слабого основания и анионом сильной кислотой;
4) соли, образованные катионом слабого основания и анионом слабой кислотой.
| Основания | |
| Сильные | щелочи – LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
| Слабые | как правило, нерастворимые основания – Mg(OH)2, AI(OH)3, Cr(OH)3, Fe(OH)2, Fe(OH)3, Zn(OH)2, Pb(OH)2, Cu(OH)2; гидрат аммиака NH3 · H2O (или NH4OH) |
| Кислоты | |
| Сильные | HNO3, HCI, HBr, HI, HCIO4, HMnO2, H2SO4 |
| Слабые | органические кислоты – HCOOH, CH3COOH, C6H5COOH; неорганические – HF, H2S, H2CO3, HNO2, HCN, H3BO3, HCIO, HCIO2, H2SiO3, Н3РО4 |
Типы солей
| соли, образованные катионом сильного основания и анионом сильной кислоты | Na2SO4, KNO3 |
| соли, образованные катионом сильного основания и анионом слабой кислоты | Na2CO3, CH3COOK |
| соли, образованные катионом слабого основания и анионом сильной кислотой | ZnCI2, Cu(NO3)2 |
| соли, образованные катионом слабого основания и анионом слабой кислотой | (NH4)2S, (CH3COO)2Cu |
Окраска индикаторов
| Нейтральная среда | Кислая среда | Щелочная среда | |
| лакмус | фиолетовый | красный | синий |
| метиловый оранжевый | оранжевый | розовый | желтый |
| фенолфталеин | бесцветный | бесцветный | малиновый |
| рН | рН = 7 | рН < 7 | рН > 7 |
Хотя гидролиз солей – разновидность реакции обмена, технология составления уравнений реакций этого процесса имеет свои особенности. Главное отличие – то, что в этом случае сначала составляют ионное уравнение реакции, а затем не его основе записывают молекулярное.
Алгоритм составления уравнения реакции гидролиза
ВНИМАНИЕ! Диссоциация молекул воды – не происходит. Уравнение диссоциации воды записывается только для того,
чтобы правильно составить уравнение гидролиза!!!
1. Анализируют состав соли:
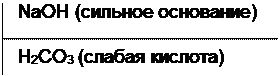 Na2CO3
Na2CO3
2. Выбирают ион, подвергающийся гидролизу:

|
 HOH ↔ H+ + OH-
HOH ↔ H+ + OH-
|
3. Из полученного уравнения составляют молекулярное, используя те ионы, которые принимали участие в гидролизе:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
среда раствора соли – щелочная
 2020-08-05
2020-08-05 233
233







