Гидролиз этого типа иначе называют гидролизом по катиону, и аниону. В соли слабого основания и слабой кислоты, например сульфиде алюминия AI2S3, катион ведет себя как кислота, а анион – как – основание:
AI2S3 + 6H2O = 2AI(OH)3 ↓ + 3H2S↑
Реакция идет полностью до конца и гидролиз необратим. Реакция и рН среды растворов данных солей зависит от относительной силы
образующихся слабых кислот и оснований и может быть либо нейтральной, либо незначительно смещенной в ту или иную сторону, т.е. слабокислой или слабощелочной.
Смещение химического равновесия при гидролизе
На процесс гидролиза значительное влияние оказывают концентрация и температура. В соответствии с принципом Ле Шателье рассмотрим влияние этих факторов на положение гидролитического расщепления.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (в данном случае воды). Следовательно, равновесие смещается вправо, т.е. гидролиз усиливается. Наоборот, гидролиз концентрированных растворов протекает значительно слабее.
Изменение температуры влияет на гидролиз вследствие резкой температурной зависимости степени диссоциации воды. С повышением температуры концентрация Н+ и ОН- ионов в растворе резко возрастает, вследствие чего увеличивается вероятность связывания их с образованием малодиссоциированной кислоты или основания. Поэтому с повышением температуры гидролиз протекает полнее.
Данный вывод подтверждается тем, что реакция нейтрализации экзотермична. Так как гидролиз является противоположным ей процессом, т.е. эндотермичен, то в соответствии с принципом Ле Шателье нагревание вызывает усиление гидролиза.
НЕОБРАТИМЫЙ ГИДРОЛИЗ НЕОРГАНИЧЕСКИХ И ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Необратимый гидролиз солей кислородсодержащих солей (катион слабого основания и анион слабой кислоты)
При сливании водных растворов карбоната натрия Na2CO3 и хлорида алюминия AICI3 выделяется газ и выпадает осадок. Что это за осадок и какой газ может выделяться в данной обменной реакции? Если мы посмотрим в таблицу растворимости, то в клетке, соответствующей карбонату алюминия, увидим прочерк. В данном случае это означает, что соль разлагается водой, т.е. протекает ее необратимый гидролиз.
|
|
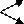 3CO2↑
3CO2↑
2AI3+ + 3CO 2- + 6H O ↔ 2AI(OH) ↓ + 3H CO
3 2 3
2 3
3H2O
Подобным образом полностью гидролизуются сульфиты алюминия и хрома (III), карбоната железа (III) и некоторые другие соли кислородсодержащих кислот. Их нельзя получить реакцией обмена между водными растворами двух солей, содержащих соответствующие ионы.
 2020-08-05
2020-08-05 169
169








