Типы солей и характер их гидролиза
Соль образована катионом сильного основания и анионом сильной кислоты.
Соли этого типа гидролизу не подвергаются, так как при их взаимодействии с водой равновесие ионов H+ и ОН- не нарушается. В растворах таких солей среда остается нейтральной (рН = 7).
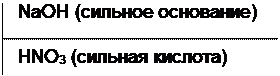 NaNO3
NaNO3
 NaNO3 + HOH
NaNO3 + HOH
Соль, образованная катионом сильного основания и анионом слабой кислоты.
Гидролиз этого типа солей иначе называется гидролизом по аниону. Рассмотрим в качестве примера гидролиз K2SO3
 К2SO3
К2SO3
|
 HOH ↔ H+ + OH-
HOH ↔ H+ + OH-
|
K2SO3 + HOH ↔ KHSO3 + KOH
среда раствора соли – щелочная
Таким образом, каждый ион Н+ нейтрализует одну единицу отрицательного заряда иона кислотного остатка СО 2-, а из молекулы воды НОН освобождаются гидроксид-ион ОН-. Эти ионы гидроксида ОН-, будучи в избытке, придают щелочную реакцию (рН>7).
3
Следовательно, растворы солей, образованные сильным основанием и слабой кислотой, имеют щелочную реакцию.
Данный случай гидролиза обратим.
Соль, образованная катионом слабого основания и анионом сильной кислоты.
Гидролиз этого типа солей иначе называют гидролизом по катиону. Рассмотрим гидролиз хлорида меди (II) CuCI2
 СuSO4
СuSO4
|
 HOH ↔ H+ + OH-
HOH ↔ H+ + OH-
|
2CuSO4 + 2HOH ↔ (CuOH)2SO4 + H2SO4
среда раствора соли – кислая
В растворе наблюдается избыток ионов Н+. Следовательно, растворы солей, образованные слабым основанием и сильной кислотой, имеют кислую реакцию (рН<7).
Данный случай гидролиза также обратим.
 2020-08-05
2020-08-05 232
232








