МО — отдаленные метастазы не выявляются.
Ml — выявляются отдаленные метастазы, включая поражение кожи
за пределами молочной железы.
Группировка по стадиям
Tis — Carcinoma in situ (стадия 0)
Инвазивная (инфильтративпая) карцинома
Стадия I: T1a NO или N1a МО
T1b NO или N1a
Стадия II: ТО N1b
T1a N1b
T1b N1b
T2a NO или N1a МО
T2b NO или N1a
T2a N1b
T2b N1b
Стадия III: любая ТЗ с любыми N
любая Т4 с любыми N МО
любая Т с N2
любая Т с N3
Стадия IV: любая Т, любые N с Ml
Там, где повседневно применяется маммография, размер опухоли измеряют на маммограммах. В этих случаях он оказывается меньше размеров, определяемых кронциркулем, но
более точно соответствует размерам, определяемым морфологами. В центрах, использующих маммографию, окажется больше больных с Т1 и Т2.
В пашей стране подавляющее число онкологов определяют размеры опухоли циркулем. Размер определяется до начала лечения. Если лечение начиналось с операции, то следует отметить размер опухоли, определяемый на послеоперационном препарате, но при этом классификация Т, определенная до операции, не изменяется. Если до операции проводилась химиотерапия, лучевая или гормональная терапия, сохраняется размер опухоли Т, определенный клинически до начала лечения, размер опухоли или ее исчезновение после лечения, определяемые на препарате после операции, отмечаются, но не изменяют клиническую оценку, выставленную до начала лечения.
Малые кожные признаки, втяжение кожи над опухолью или втяжение соска могут иметь место и при Т1, Т2, ТЗ. Прямое прорастание кожи следует относить к Т4. К Т4Ь следует также относить полную фиксацию кожи над опухолью.
Определение состояния лимфатических узлов и их классификация устанавливаются клинически, до начала лечения. Если лечение начинается с операции, то после гистологического-исследования вносится поправка N— (минус) или N+ (плюс). Если до операции применялся любой вид терапии, сохраняется определенная до лечения классификация узлов. (Данные гистологического исследования отмечаются, но на стадийность не влияют.) N1a и N1b отмечать не обязательно, но это дает возможность клиницисту более точно оценивать свой клинический опыт.
Наш опыт показывает, что метастазы в подключичные лимфатические узлы редко выявляются до операции. При выявлении их во время операции и последующем гистологическом подтверждении следует учитывать и вносить соответствующую' поправку в определение стадии заболевания.
Группировка по стадиям необходима, так как клинический опыт показывает, что выживаемость больных, развитие рецидивов и метастазов находятся в прямой зависимости от стадии, определяемой до начала терапии. Оценка результатов методов терапии и сравнение их ценности невозможны без предварительного определения стадии заболевания.
До введения классификации TNM в разных странах клиническая классификация и определение стадии проводились различно. Большинство авторов до введения классификации TNM оценивали первичный рак молочной железы в двух группах:
I группа — локализованный рак; опухоли до 5 см при отсутствии метастазов в регионарные лимфатические узлы (доказано гистологически) и без отдаленных метастазов. II группа — опухоли более 5 см и опухоли любых размеров при наличии регионарных метастазов.
В соответствии с отечественной старой номенклатурой, которая широко применяется онкологами в нашей стране до настоящего времени, в I группу входят больные с I и 2а стадиями, а' по II группу—больные всеми остальными стадиями, начиная со 2б. Так как до введения классификации TNM, а рядом авторов и в настоящее время результаты разных методов терапии оцениваются и публикуются по этой форме: локализованный рак (без метастазов) и нелокализовапный рак (с метастазами),. мы упоминаем и эту группировку.
В пашей стране применяется отечественная номенклатура определения стадийности: I, 2а, 26, 3a, 36 и 3 стадии первичного рака молочной железы; IV стадия — наличие отдаленных метастазов.
Точно сопоставить отечественную клиническую классификацию и классификацию по системе TNM трудно. Приблизительное сопоставление: I и 2а стадии соответствует T1,2NOMO;
2б стадия соответствует T1,2N1MO; III стадия соответствует любому Т при N2, 3 МО.
Классификация по системе TNM несомненно дает больше ин формации для определения стадийности заболевания, хотя и не лишена значительных недостатков. Так, обозначение Та и ТЬ можно определять только после операции при морфологическом исследовании, если же проводилась предоперационная терапия даже морфологическое исследование не может уточнить этот признак. Классификация применима только для узловой формы рака молочной железы. Отечно-инфильтративные и другие фор.мы диффузного рака не находят отображения в этой классификации. Не учитывается степень распространения кожного
•симптома «апельсиновой корки». В случаях отсутствия пальпируемого узла при опухолевых инфильтратах, распространенных на большую часть молочных желез, трудно поддающихся измерению, невозможно оценить признак Т. Не учитывается гиперемия кожи при ннфильтративных формах рака, свидетельствующая об инвазии внутрикожных лимфатических сосудов, что крайне отягчает прогноз. Нет различий для первично-инфильтративного отека и вторичного отека молочной железы, "возникающего при блокаде лимфатических узлов. Мы полностью согласны с мнением В, Н. Демина с соавт. (1976), поставивших вопрос о необходимости дополнения к системе TNM факторов для оценки инфильтративно-отечных форм рака молочной железы. Мы считаем, что при этих формах должны учитываться состояние кожи, наличие гиперемии, площадь распространения симптома «апельсиновой корки», распространение опухолевого инфильтрата на треть, половину или более половины молочной железы (при различных размерах молочных желез размеры инфильтратов могут быть очень различны, так в маленькой железе инфильтрат 5—6 см может занимать почти весь орган — тотальная инфильтрация, а в больших железах такой размер инфильтрата занимает лишь один квадрант или центр железы, и несомненно, что для прогноза большее значение имеет относительный, а не абсолютный размер инфильтрата). Поэтому, распределяя больных по системе TNM, специалисты должны вносить дополнительные, выявленные для каждого отдельного случая факторы.
При распространенных стадиях также очень трудно оценить состояние лимфатических узлов. Так, большое количество мелких метастатических, но клинически подвижных узлов, не
-спаянных друг с другом, оценивается как N1, а практически они должны расцениваться как N2. Нередко при операции и после нее выявляется большое число крупных метастатических узлов в аксиллярной и подлопаточной областях, и по системе TNM они относятся к N2, а фактически их следует относить к N3.
Хирург должен после операции детально рассмотреть удаленный препарат, оценить состояние молочной железы, распределение и характер опухоли, состояние лимфатических узлов.
Желательно, чтобы это производилось совместно с патоморфологом и находило свое отражение в записи операции и описании макропрепарата. Такая оценка послеоперационной находки поможет врачу повысить квалификацию и даст возможность более точно определять степень распространения процесса, а следовательно, вырабатывать более рациональный индивидуальный план терапии.
Диагностика. При раке молочной железы диагностика основывается на клинических признаках и данных дополнительных методов обследования: аспирационной биопсии с цитологическим исследованием, биопсии со срочным гистологическим исследованием, маммографии, термографии и пр.
Обследование нужно начинать с изучения анамнеза заболевания и общего анамнеза, включая акушерско-гинекологический. После сбора анамнеза следует перейти к осмотру больной и пальпации молочных желез.
Больная, раздетая до пояса, должна встать перед равномерно освещающим источником света. При осмотре следует обращать внимание на форму и размеры молочных желез, симметричное или асимметричное их расположение, уровень стояния сосков, их форму, наличие или отсутствие деформации и втяжения, состояние кожи, деформацию одной или обеих молочных желез. Надо осмотреть больную при опущенных руках, а затем попросить ее поднять руки вверх, завести их за спину. При этом можно выявить ограничение подвижности одной из желез, появление втяжения кожи над опухолью или втяжение соска.
Пальпация молочных желез должна производиться в положении больной стоя и лежа. Изучают состояние сосков, ареол: плотность, утолщение складки ареолы, наличие или отсутствие выделений. Осторожно собирая кожу железы в складки, выявляют кожные симптомы — морщинистость или втяжение, лим-фостаз, симптом «лимонной корки». После поверхностной производят глубокую пальпацию, при которой изучают состояние железистых долек и определяют характер опухоли или другого образования в железе. Исследование проводят вначале кончиками пальцев обеих рук, а затем захватывают ткань железы между пальцами одной руки. Исследуют сначала одну, а затем другую молочную железу, последовательно прощупывая все их отделы по направлению от соска к периферии или наоборот. Такое прощупывание железы дает возможность определить опухоль.
При выявлении опухоли производят более тщательную пальпацию соответствующей области для определения размеров, формы, консистенции, подвижности молочной железы и опухоли, состояния кожи над опухолью. Следует, встав сзади больной, прижать участок молочной железы с выявленным уплотнением ладонью к грудной стенке. Раковые опухоли и фиброаденомы при этом приеме сохраняют свою форму и консистенцию, мастопатические узлы становятся меньше, мягче нли вовсе скрываются в ткани железы — это симптом Кенига, или ладони. После обследования больной в вертикальном положении она должна лечь па спину, все обследование повторять в той же последовательности. После осмотра и пальпации молочных желез производят осмотр и пальпацию подмышечных, подключичных и надключичных областей с обеих сторон, чтобы выявить состояние лимфатических узлов.
Клинические признаки рака молочной железы I и II стадий:
1) наличие четко определяемого опухолевого узла в молочной железе;
2) плотная консистенция опухоли;
3) ограниченная подвижность опухоли в железе;
4) наличие кожных симптомов (морщинистости или втяжения кожи над опухолью, определяемого при захватывании или сдвигании кожи);
5) утолщение соска и складки ареолы в той железе, где определена опухоль — симптом Краузе;
6) безболезненность опухоли;
7) наличие одиночного или нескольких небольших плотных подвижных узелков в подмышечной впадине на стороне поражения.
Клинические признаки поздних стадий рака молочной железы III и IV стадий:
1) наличие четко определяемого большого опухолевого узла или инфильтрата в молочной железе;
2) плотная консистенция опухоли, наличие участков размягчения;
3) ограниченная подвижность опухоли;
4) значительные уплотнения и утолщения соска и складки ареолы в той молочной железе, где определена опухоль;
5) заметное втяжение кожи в месте определяемой опухоли, симптом умбиликапии или площадки, или появление этих признаков при сдвигании кожи над опухолью;
6) явления лимфостаза — симптом «лимонной корки» над опухолью или за ее пределами
7) изъязвление кожи или прорастание опухоли над поверхностью кожи в виде плотных, частично изъязвляющихся покрытых корками узелков;
8) легкая гиперемия кожи молочной железы и за ее пределами — специфический лимфангит;
9) втяжение и фиксация соска;
10) деформация молочной железы; уменьшение или увеличение размеров, подтягивание вверх или в стороны, фиксация железы к грудной стенке;
11) большие метастатические, ограниченно подвижные или неподвижные узлы или инфильтраты в подмышечной впадине на стороне поражения;
12) надключичные метастазы на стороне поражения, подмышечные пли надключичные метастазы на противоположной стороне (перекрестные метастазы);
13) боли в молочной железе;
14) отек руки, боли в пей;
15) отдаленные метастазы, выявляемые клиническим или рентгенологическим исследованием, симптоматика, им соответствующая.
Сочетание нескольких из перечисленных признаков характеризуют степень распространенности рака молочной железы и клиническую стадию заболевания.
Если проведенное обследование не дает уверенности в диагнозе, то следует прибегнуть к дополнительным методам обследования.
Аспирационная биопсия и цитологическое исследование дают возможность выявить клетки злокачественного новообразования. Цитологическому исследованию подвергают выделения из сосков, отпечатки с поверхности язв и пунктаты из пальпируемых уплотнений или опухолей,
В хорошо организованной лаборатории с опытным цитологом диагноз рака при цитологическом методе может быть установлен более чем в 80% случаев. При некоторых формах опухолей, богатых стромой (скирр), а также при маленьких, глубоко расположенных опухолях цитологическое заключение оказывается трудным пли невозможным. Отрицательный цитологический ответ не отрицает диагноза рака, который должен в трудных случаях устанавливаться по комплексу клинических признаков и данным дополнительных методов обследования. В этих случаях окончательный диагноз, как правило, устанавливается срочным гистологическим исследованием опухоли, иссеченной в пределах здоровых тканей.
Во всех случаях, когда лечение начинается не с операции (лучевая, химио- и гормонотерапия), клинический диагноз должен быть подтвержден цитологическим исследованием или срочным гистологическим исследованием.
Маммография. Различают контрастную и бескоптрастную маммографию. Контраст вводят в выводное отверстие на соске, из которого при надавливании появляются выделения. Этот метод позволяет выявить локализацию патологического процесса и указывает, где следует производить секторальную резекцию в тех случаях, когда не удается прощупать уплотнения в молочной железе.
Бесконтрастная маммография осуществляется при наличии уплотнений в молочных железах, которые клинически трудно отдифференцировать от раковых опухолей. При раковых опухолях определяется тень без четких контуров с отходящими в ткань железы лучами, при мастопатин — диффузное, тяжистое затемнение молочной железы или ее отделов с просветлениями (кисты), при фиброаденомах—четко очерченное затемнение;
могут выявляться тяжистость и мелкие просветления в тех случаях, когда одновременно имеется мастопатия. Мелкие точечные
кальципаты в зоне затемнения могут отображать малигпизацпю па фоне мастопатии.
Крупнокадровая флюорография. Крупнокадровая флюорография молочных желез, производимая на специальных приставках к флюорографическим аппаратам, не может дать точного диагноза. При этом могут быть выявлены или большие опухоли, пли флюорографическая картина показывает какое-то различие одной и другой молочных желез. Поэтому флюорографическое исследование молочных желез может иметь значение для первичного отбора лиц, подлежащих обследованию при массовых профилактических осмотрах женщин. Дальнейшее более тщательное обследование должны проводить специалисты.
Биопсия при подозрении па рак молочной железы должна производиться по типу секторальной резекции. Подозрительный участок железы иссекают вместе с кожей через всю толщу тканей (включая фасцию большой грудной мышцы), отступя па 3—4 см от определяемого пальпаторно опухолевого узла, п подвергают срочному гистологическому исследованию.
При выявлении рака должна быть немедленно произведена радикальная мастэктомия.
Дифференциальный диагноз. Кроме мастопатии, фиброадс-иом и рака молочной железы, дифференциальный диагноз между которыми уже описан, в молочных железах могут быть и другие патологические процессы и опухоли.
Липомы молочной железы встречаются редко, опп круппо-дольчаты, мягки, не имеют в центре уплотнений.
Лииогранулемы молочной железы встречаются редко. Возникают они вследствие бывших травм или ограниченных воспалительных процессов, а также в местах, куда производились ранее инъекции (антибиотики, новокаин и пр.). Липограпулс-мы ис имеют четких границ, мягки, но в центре их может быть некоторое уплотнение, а также втяженпе кожи над «опухолью», что крайне затрудняет дифференциальный диагноз с небольшими скиррознымп опухолями.
Ретепционные кисты, достигающие больших размеров тг наполненные жидким содержимым, могут симулировать раковые опухоли. Пункция и цитологическое исследование в большинство случаен помогают установить диагноз.
Галактоцеле напоминают крупные кисты, развиваются в период лактации или после окончания ее и могут сохраняться длительно. Анамнез помогает дифференциальному диагнозу. Окончательный диагноз устанавливается при пункционной биопсии или секторальной резекции.
Ангиомы молочной железы встречаются редко, не имеют четких границ, мягки на ощупь, уменьшаются при сдавлении. При поверхностном расположении имеют типичную голубоватую окраску или багровый цвет.
Добавочные молочные железы чаще располагаются на месте пересечения передней аксиллярной линии и края большой грудной мышцы или ниже молочной железы, ареола и сосок выражен редко. Часто определяются во второй половине беременности или в период лактации.
Значительные затруднения в диагностике возникают при туберкулезе и актиномикозе молочных желез. Эти заболевания в настоящее время встречаются редко. Правильно собранный анамнез облегчает диагноз. При исследовании выделении из свищей или содержимого, полученного при пункции, можно обнаружить туберкулезные микобактерии или друзы актино-микоза.
Значительные трудности возникают при дифференциальном диагнозе между острыми воспалительными процессами и мас-титоподобной и эризипелоидной формами рака.
Совпадение острого начала с периодом лактации, повышение температуры, сильные боли в начале заболевания позволяют поставить правильный диагноз. Если лечение острого мастита (ретромаммарная повокаиновая блокада, масляно-бальзамические повязки, лучевая терапия, лечение антибиотиками и другие противовоспалительные средства) не купируют процесса в течение нескольких дней, особенно если заболевание развивается у пожилых женщин и вне периода лактации, то следует думать о раке и провести тщательное дополнительное обследование (пункционная или инцизионная биопсия, цитологическое или гистологическое исследования).
Саркома молочных желез встречается редко, составляя 1—3% опухолей молочных желез. Саркомы отличаются быстрым ростом, большими размерами, крупнобугристой поверхностью, неравномерной плотностью с участками размягчения. Кожа молочных желез над саркоматозными опухолями топка, как бы растянута, слегка гиперемирована, просвечивают расширенные подкожные вены. Лимфатические узлы, несмотря на наличие большой опухоли, не увеличены.
Молочные железы могут быть поражены системными заболеваниями: лимфогранулематозом, ретикулезом пли ретикуло-саркоматозом, лимфосаркоматозом, острым лейкозом. Первичное поражение молочных желез при этих процессах почти не встречается. Кроме того, имеются общие признаки, характерные для указанных заболеваний: повышение температуры, кожный зуд, общая слабость, специфические изменения периферической крови. Почти всегда выявляются другие очаги заболеваний.
Лечение. Лечение рака молочной железы включает ряд последовательных мероприятий. В план лечения входят хирургические, лучевые, гормональные и химиотерапевтические методы.
План лечения вырабатывается индивидуально. В составлении его должны участвовать онкологи разных профилей: онколог общего профиля, который осуществляет наблюдение за больной и обеспечивает проведение всего комплекса лечебных мероприятии, специалисты по методам гормонотерапии и химиотерапии, лучевой терапевт, который проводит при показаниях тот или иной этап лучевой терапии.
При составлении плана лечения должны быть учтены следующие основные моменты: 1) локализация и степень распространения опухолевого процесса; 2) возраст больной и состояние ее оиариалыю-менструальнои функции; 3) наличие сопутствующих заболеваний (в первую очередь — состояние сердечнососудистой системы, печени, матки ц придатков, наличие диабета, язвенной болезни п пр.); 4) проводившееся в прошлом лечение, особенно в последние 3 мес до начала комплексной терапии и выявление возможного угнетения кроветворения (при рецидивах и метастазах).
Все этапы и последующее наблюдение за больными желательно проводить в одном н том же лечебном учреждении, а при невозможности осуществить это необходимы периодические консультации со специалистами, наметившими первоначальный план лечения. При этом некоторые этапы терапии дол/кны осуществляться в стационаре лечебного учреждения, другие же можно проводить амбулаторпо. Желательно, чтобы дальнейшее наблюдение и повторное лечение осуществляла одна и та же группа врачей, проводивших первоначальное лечение.
В процессе терапии возможно изменение первоначального плана или проведение дополнительных методов терапии.
В зависимости от стадии заболевания могут быть рекомендованы различные схемы терапии.
При первичном раке I, II, III стадий, когда процесс локализуется в железе и регионарпых лимфатических узлах, план лечения должен включать: а) оперативное удаление первичного очага н доступных регионарных метастазов; б) профилактические мероприятия для предупреждения возникновения метастазов и рецидивов (лучевая, гормоно- или химиотерапия).
При первично неоперабельнои раке, рецидивах н при отдаленных метастазах после проводившегося ранее лечения на керпый план выступают гормоно- и химиотерапия. Лучевая терапия, и в отдельных случаях оперативные вмешательства, являются дополнительными методами.
Как показывают материалы Международного комитета по учету отдаленных результатов терапии злокачественных опухолей, независимо от разных методов лечения первичного рака молочных желез пятилетняя выживаемость оказывается почти одинаковой, но с несколько лучшими данными при применении чисто хирургических методов при I — II стадиях.
Аналогичные данные сообщил Ю. В. Петров (1964) по материалам ЛОИ им. Н. Н, Петрова. Автор сообщает, что, несмотря на одни и те же стадии заболевания, в группы больных, получавших комбинированное лечение, отбирались больные 'с худшим прогнозом.
По данным Ф. И. Янишевского (1966) на материале МИНОЙ им. П. А. Герцена, применение лучевой терапии в сочетании с операцией улучшает результаты лечения в некоторых группах, но разница эта статистически недостоверна, так как число больных в разных сериях наблюдений весьма различно. А. П. Баженова (1976) приводит данные по этому институту за последующие годы.
Комбинированная терапия, по мнению ряда авторов, влияет на появление рецидивов и метастазов в кожу и региояариые лимфатические узлы, несколько отодвигая сроки появления и уменьшая число узлов, но не влияет на выживаемость больных.
Сочетание операции с облучением (в разных вариантах) принято называть комбинированной терапией. Так как в нашей стране наиболее распространен комбинированный метод терапии первичного рака молочных желез, мы приводим результаты этого метода, хотя они и имеют давность более 10—15 лет. Неудовлетворенность результатами комбинированной терапии повела к поискам новых методов, при которых мастактомпя (удаление первичного опухолевого очага и регионарных метастазов) сочетается с общими воздействиями — химио- и гормонотерапией. Указанные два метода, применяемые после маст-эктомин, служат профилактикой регионарных и отдаленных метастазов. Было необходимо длительное время для накопления п анализа клинических наблюдений, поэтому первые публикации результатов применения новых методов появились в конце 60-х и в 70-х годах,
С целью профилактики рецидивов и метастазов при раке молочных желез предложено производить после мастэктомпи лучевое подавление функции яичников или хирургическое удаление их у больных с сохраненными менструальными циклами.
Kennedy (1956) в обзорной статье приводит данные многочисленных авторов, касающиеся этого вопроса. Так же как и другие авторы, он приходит к выводу, что овариоэктомия, произведенная у молодых женщин после мастэктомии, несколько отодвигает сроки появления рецидивов и метастазов, но но влияет существенно на общую пятилетнюю выживаемость. Rennal (1958) сообщает, что после того, как в Норвегии стали применять профилактическое лучевое подавление функции яичников при лечении первичного рака молочных желез, пятилетняя выживаемость в стране повысилась с 44 до 56,8%, причем при II стадии у больных, получавших облучение яичников, она достигла 62,6%, а у больных, не получавших облучения,.составляла 45,5%.
По данным отечественных авторов (Л. М. Гольдштейн, 1951;Ё. Е. Чеботарев, 1952, 1955; А. В. Козлова, 1956; Ю. В. Петров, 1964, и др.), при применении овариэктомии или лучевого подавления функции яичников после мастэктомии, проведенной в I, II, III стадиях заболевания (в первые 2—3 года), число рецидивов и метастазов по сравнению с группой больных, не подвергшихся кастрации, значительно снижается.
Сочетание трех и более методов при лечении первичного рака молочных желез, в отличие от комбинированной терапии (операция + облучение), мы обозначаем «комплексная терапия».
В ОНЦ АМН СССР при лечении 473 больных за 1955— 1967 гг, был применен комплексный метод в двух вариантах:
1) радикальная мастэктомпя по Холстеду+послеоперационная лучег.пя терапия + длительная гормопопрофилактика; 2) радикальная мастэктомия по Холстеду+химиотерапия (тиофосфа-мид) + длительная гормонопрофилактика. Контрольная группа больных в послеоперационном периоде получала лишь лучевую терапию (комбинированная терапия). Мы проследили пяти- и десятилетний период течения заболевания без рецидивов и метастазов в этих группах, сроки исчислялись со дня мастэктомии. При локализованном процессе рака молочной железы (T1,2NO) мы не выявили существенной разницы результатов терапии в зависимости от проведенного метода. Процент пяти и десятилетнего течения заболевания без проявления метаста-зирования пли местного рецидива был одинаково высок во всех трех группах.
При II стадии заболевания (T1,2N1), когда имелись одиночные метастазы в регионарные лимфатические узлы, доказанные гистологическим исследованием, число больных, проживших 5 и 10 лет без рецидивов и метастазов, на 10—15% больше в группах, где проводилась комплексная терапия, по сравнению с группами, в которых проводилось комбинированное лечение. Особенно существенна разница при III стадии заболевания. Количество больных, проживших срок от 5 до 10 лет без рецидивов и метастазов, оказалось в 2 и более раза больше при проведении комплексной терапии по сравнению с комбинированным лечением. При этом вариант комплексного лечения, включавшего химиотерапию, оказался несколько более эффективным, чем вариант, включающий лучевую терапию.
Та же закономерность сохранилась и при анализе выживаемости в сроки 5 и 10 лет от начала терапии. Выживаемость больных с I и II стадиями заболевания остается почти равной во всех трех группах. Выживаемость больных III стадии заболевания, особенно при наличии N3, оказалась существенно выше в группах комплексной терапии по сравнению с комбинированным лечением. При комбинированной терапии 5 и 10 лет прожили соответственно 50 и 30% больных (Tl, 2N2) и 14,3% и 0 (Т2, 3, 4N3), а при комплексной терапии соответственно 88,6—63% и 46,7—26,6%.
Результаты лечения двух групп больных, получавших комплексную терапию, существенно не отличались в зависимости от того, проводилась ли на фоне длительной гормонотерапии лучевая или химиотерапия. Но результаты оказались значительно лучше при сочетании трех методов терапии. В свете этих фактов мы считаем, что именно длительное гормональное лечение повлияло на увеличение продолжительности периода безрецидивного течения заболевания и тем самым способствовало повышению процента пяти- и десятилетней выживаемости.
Аналогичные данные получены при кооперированном исследовании в СССР (А. М. Гарин, Н. И. Карев и др., 1973-1976).
Применение после радикальной мастэктомии тиофосфампда оказалось эффективнее других методов.
Л. Ю. Дымарский и Я. Л. Бавли сообщили (по материалам ЛОИ им. Н. Н. Петрова, 1976) о результатах лечения больных раком молочной железы с применением послеоперационной химиотерапии и без нее.
Послеоперационная химиотерапия повысила пятилетнюю выживаемость при разных стадиях заболевания в среднем на 10—17%.
Хирургические методы. Хирургические вмешательства — одно из основных мероприятий в комплексном лечении рака молочной железы.
Наиболее распространенный вид оперативного вмешательства — радикальная мастэктомия по Холстеду — Майеру, пред
ложенная ими независимо друг от друга в 1891—1892 гг. Молочную железу удаляют единым блоком с грудными мышцами и клетчаткой подмышечной, подключичной областей и пространства между грудной стенкой и наружным краем лопатки. Применяются различные модификации радикальной мастэктомии, которые касаются формы и направления кожных разрезов, иссечения или сохранения малой грудной мышцы, ножевого или электрохирургического методов рассечения тканей и т. д.
За последние годы наметились две тенденции. Первая — расширение объема оперативного вмешательства: удаление при мастэктомии загрудинных и надключичных лимфатических узлов; вторая—уменьшение объема вмешательства: проведение простой мастэктомии или секторальной резекции с последующей лучевой или гормональной терапией.
Расширенная мастэктомия. При локализации опухоли в центральных отделах и во внутренней половине железы первичное мстастазирование может иметь место не только в подмышечных, по одновременно или в первую очередь в пара-сторпальных лимфатических узлах.
Urban (1951—1952) и MargoUmi (1948. 1954) считают, что у каждой 4—5-й больной к моменту операции имеются метастазы в парастернальные лимфатические узлы.
Впервые расширенные радикальные мастэктомии начали производить Veronesi (1943), Margittini (1948, 1951), Dahl Jversen (1951). В нашей стране впервые начал производить расширенную мастэктомию А. С. Холдин (1955).
По данным авторов, располагающих наибольшим числом наблюдений по расширенным мастэктомиям, процент метастазов в парастернальные лимфатические узлы колеблется от 20 до 30. Подмышечные узлы поражаются чаще парастернальпых, на втором месте — одновременное поражение подмышечных и парастсрнальных узлов и в небольшом числе поражаются только парастернальные узлы.
Расширенная радикальная мастэктомия показана при локализации опухоли во внутренних и центральном отделах железы только тогда, когда во время операции не выявляется поражения подмышечных и подключичных лимфатических узлов (N2,3). В III стадии заболевания, по мнению С. А. Холдина (1973), расширенная мастэктомия не может быть радикальной и потому бессмысленна. Противопоказана эта операция при отечно-ипфильтративных формах. По данным автора, пятилетняя выживаемость после подмышечно-грудных мастэктомии (218 больных) на 8,4% выше, чем после мастэктомип по Холстеду (220 больных) — соответственно 70,2% и 61,8%. При поражении одной группы узлов пятилетняя выживаемость в обеих группах равноценна: 69 и 70%. При поражении парастернальных, подмышечных и подключичных узлов пятилетняя выживаемость резко снижается.
По данным Durban (1962), из 460 больных, подвергшихся расширенной радикальной мастэктомпи, прожили 5 лет 250 (67%), из них у 33% было поражение парастернальных лимфатических узлов. Общий же процент больных с метастазами в лимфатические узлы составлял 55. В 1977 г. Veronesi сообщил, что из 703 больных, подвергшихся расширенной мастэктомин, 5 лет прожили 72%, а из 750 больных, перенесших радикальную мастэктомию по Хол-стеду,—69%. На этом основании автор пришел к заключению, что расширенная мастэктомия не улучшает результатов по сравнению с радикальной мастэктомией. Некоторое улучшение результатов имеется при проведении расширенных мастэктомий при внутренней локализации опухоли.
По мнению большинства авторов, показания к расширенной радикальной мастэктомии следует ставить очень осторожно. Противопоказаниями служат пожилой возраст, сердечно-сосудистые и легочные заболевания, сопутствующие заболевания другого характера и пр.
В 1952 г. Wagensteen предложил еще в большей степени расширить объем оперативного вмешательства и удалять не только подмышечные, подключичные и парастернальные узлы, но и надключичные. Однако тяжесть оперативного вмешательства, повышение послеоперационной смертности и отсутствие убедительных данных, свидетельствующих об улучшении отдаленных результатов, привели к тому, что это предложение не нашло последователей.
Введение методов лучевой терапии и совершенствование их повели к тенденции сужения объема оперативного вмешательства. McWhirter n 30—40-х годах предложил заменить радикальную мастэктомию простой мастэктомией (без удаления подмышечной клетчатки) с последующей лучевой терапией^ предпочтительно дистанционной гамма-терапией.
Простую мастэктомию как паллиативное мероприятие при первично неоперабельном раке молочной железы с распадом или изъязвлением производят многие онкологи. Применяют простую мастэктомию также при общих противопоказаниях к большим оперативным вмешательствам: преклонный: возраст, диабет, сердечно-сосудистые заболевания в стадии субкомпенсации и пр. McWhirter, (1955), Lewisson (1963), Shimkin (1952, 1957) считают, что процент больных, проживших 5 лет после простой и радикальной мастэктомии, одинаков.
Секторальная резекция с последующей интерстнцнальной радиевой терапией предложена Keynisg в 1937 г. В нашей стране этот метод лечения применен Ф. И. Янишевским (1958), А. В. Кантиным (1963), А. П. Баженовой (1973). Использование этого метода возможно при небольших молочных железах. При массивных молочных железах приходится внедрять много радиоактивных препаратов. Получаемая в этих случаях общая доза облучения непереносима. При примононпп указанного метода возникают как непосредственные, так и отдаленные осложнения: некрозы кожи, клетчатки, ребер, медиастиниты, тяжелые лучевые невриты, склероз клетчатки, симулирующий рецидив.
Используются различные модификации метода: а) предоперационная рентгенотерапия или гамма-терапия; секторальная резекция, внедрение радиоактивных препаратов; б) секторальная резекция и внедрение радиоактивных препаратов; в) внедрение радиоактивных игл без предварительного иссечения опухоли.
Непосредственно после иссечения опухоли в молочную железу внедряют иглы, содержащие радиоактивные вещества (радий. 60Со), распределяемые в железе, подлопаточной, подключичной, подмышечной, надключичной и парастернальной областях. Применяют иглы в оболочке-фильтре из нержавеющей стали в количестве 30—35 с активной длиной 10—50 мм, толщиной стенки 0,35 мм. Игла содержит радиоактивный кобальт-никелевый сплав с активностью от 0,5 до 5,0 мКи. Продолжительность пребывания игл в тканях составляет 5—7 дней. По данным Keynes (1937), из 325 больных, получавших такое лечение, 5 лет прожили 46%. По данным Ф. И. Яыишевского (1966), лечившего 81 больную, 5 лет прожили 70,4%: с I стадией—76%, со II стадией—69%, с III стадией—60%. Широкого распространения этот метод не получил.
Имеются отдельные сообщения о возможности секторальной резекшш в сочетании с последующими лучевыми, гормональными и химиотсрапевтическими воздействиями (McWhirter, 1955; Ф. И. Янишевский, 1964; А. П. Баженова, 1973).
А. П. Баженова сообщила результаты экономных операций, проведенных у 205 больных раком молочной железы I и 2а стадий T1.2NO: у 181 больной произведеяа секторальная резекция v 24— простая мастэктомия. Облучение выполнялось путем внутритканевой гамма-терапии, бета-терапии, Аu или дистанционной гамма-терапии на молочную железу и регио-нарные зоны. Пятилетняя выживаемость составила 70,2%, рецидивы в зоне операции—1,4%, новые опухоли в молочной железе—1,7%, регионарпые метастазы—2,4%, отдаленные метастазы—12,2%. Полученные результаты аналогичны таковым при обычных методах комбинированной терапии, В то же время почти каждый онколог располагает наблюдениями, когда секторальная резекция, произведенная при раке (вследствие диагностических ошибок или по другим причинам), приводит к быстрому рецидивированию или генерализации процесса. Поэтому секторальная резекция при раке молочной железы в настоящее время не может быть рекомендована как рутинный
метод хирургического вмешательства для применения в общей лечебной сети.
При рецидивах и одиночных метастазах в коже, подкожной клетчатке, а также метастазах, более глубоко расположенных в толще грудной стенки, производят иссечение их, сочетая хирургическое лечение с предшествующим пли последующим облучением, гормоно- и химиотерапией.
В общем плане гормонального лечения метастатического и далеко зашедшего первичного рака молочной железы с целью воздействия на эндокринный статус больных производят оварио-, адренал-илп гипофизэктомию.
Техника хирургических вмешательств при раке м о л о ч н о и ж е л е з ы. Радикальная мастэктомия по Холстеду — Майеру применяется наиболее часто. Принцип операции заключается в удалении молочной железы единым блоком с большой и малой грудной мышцами и клетчаткой из подключичной, подмышечной и подлопаточной областей. В зависимости от локализации опухоли делают разные
кожные разрезы, отступая от краев пальпируемой опухоли не менее чем на 5 см. Наиболее типичен овальный разрез кожи, начинающийся вверху от границы наружной и средней трети ключицы, огибающей железу с двух сторон и закапчивающейся у края реберной дуги по сосковой линии. Различные варианты кожных разрезов изображены на рис. 155.
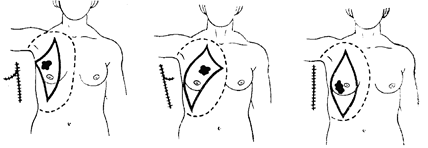
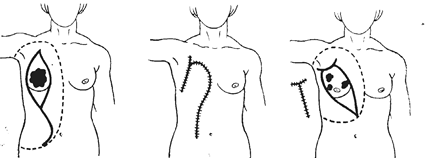
Рис. 155. Варианты кожных разрезов и границы иссечения клетчатки при. разной локализации опухолей.
Кожные лоскуты отсепаросывают кнаружи до задней аксиллярной линии, кнутри—до середины грудины, кверху до нижнего края ключицы, вниз до подложечной области и соответствующего подреберья. Отсепаровка производится в слое наружной фасции; оставляемый подкожный жировой слой не должен превышать 1 см.
После пересечения большой и малой грудных мышц вблизи мест их прикрепления выделяют клетчатку вдоль передней, нижней и задней поверхностей подключичной вены. Пересекают и перевязывают кетгутом все впадающие в вену сосуды и идущие параллельно артериальные ветви. Постепенно сдвигают клетчатку с подмышечной вены, выделяют клетчатку из подмышечной впадины и пространства между наружным краем лопатки и грудной стенкой. Выделение клетчатки производят до края широкой мышцы. После удаления молочной железы рапу орошают 96% спиртом, противоопухолевым препаратом, стерильной водой или асептической жидкостью с целью повреждения или механического удаления опухолевых клеток, вышедших во время операции из пересеченных лимфатических путей. Через контрапертуру по средней аксиллярной линии вводят резиновую дренажную трубку, немного не доводя ее до подмышечной вены. Дренажную трубку целесообразно присоединить к вакуумному аппарату, в этих случаях можно ограничиться наложением наклейки. Дренажную трубку, присоединенную к вакуумному аппарату, держат 4—5 сут, а дренаж, не присоединенный к отсосу, удаляют через 1—2 сут.
При значительном дефекте кожных покровов можно производить пластику перемещением кожных лоскутов с передней брюшной стенки пли с противоположной половины грудной стенки. При далеко зашедших стадиях рекомендуется рассекать ткани электроножом, за исключением момента отделения клетчатки вдоль вены.
Радикальная мастэктомия по Патею. Кожпые разрезы и отсепаровку кожных лоскутов производят так же, как при операции по Холстеду. Молочную железу вместе с фасцией отсепаровывают от большой грудной мышцы. При глубоком расположении опухоли следует удалить мышечные волокна непосредственно под опухолью. Край большой грудной мышцы оттягивают тупыми крючками. Пересекают малую грудную мышцу и выделяют клетчатку из подключичной, подмышечной, подлопаточной областей, как при операции Холсте-да, единым блоком с мобилизованной ранее молочной железой и малой грудной мышцей. Малую грудную мышцу удаляют с целью более тщательного унесения подключичной клетчатки. Операция эта менее травматичная, чем операция Холстеда, дает хороший косметический эффект и в меньшей степени нарушает функцию верхней конечности. М. И. Кузин с соавт., опубликовавшие в 1977 г. результаты наблюдений за 137 больными, оперированными ими этим методом по поводу рака молочной железы в разных стадиях, показали, что число местных рецидивов (3,4%) не превышает такового при операции Холстеда. Больные погибают в основном от отдаленных метастазов; выживаемость такая же, как при операции Холстеда. Мы полагаем, что эта операция может применяться у больных с I и II стадиями рака. При распространенных стадиях заболевания более радикально оперировать по Холстеду.
Радикальная резекция м о л о ч н о и железы. Производят широкую резекцию молочной железы через всю толщу тканей, включая фасцию большой грудной мышцы. Рассечение тканей железы следует производить, отступя на 4—5 см в стороны от пальпируемой опухоли. Иссеченный сок-тор заворачивают в марлевую салфетку и оставляют на ак-силлярной клетчатке. Выделяют клетчатку региопарпых зон, как при операции Патея, после чего мобилизованный ранее сектор железы удаляют единым блоком с клетчаткой регпо-парных зон и малой грудной мышцей. Эта методика операции разработана в ОНЦ АМН СССР (П. П. Блохин, О. В. Святу-хпна, В. В. Вишнякова, описана Ю. В. Фалилеевым, 1976), применяется при наружной локализации опухоли размером не более 3,5 см — T.2NO.
Широкая секторальная резекция молочной железы при опухолях 1—11 стадии (N0) любой локализации (исключая центральную) диаметром не более 5 см производится в США, Италии и других странах. Иссечение аксиллярной клетчатки при расположении опухоли во внутренней половине железы производится через отдельный разрез. В послеоперационном периоде проводится лучевая терапия. Достаточно длительно прослеженных наблюдений пока не опубликовано.
Расширенная радикальная мастэктомия с удалением п а р а с т е р и а л ь н ы х лимфатических узлов (п о д м ы ш е ч п о-г р у д и н и а я мастэктомия). Операция начинается так же, как радикальная мастэктомия, но отсечение препарата производится лишь до линии начала большой грудной мышцы вдоль края грудины и реберных хрящей от II до V ребра. Отсеченную железу с клетчаткой и мышцами изолируют полотенцем. После этого производят резекцию грудной стенки в виде пластинки, включающей край грудины, хрящи II—IV ребер и соответствующие межреберные мышцы вместе с расположенной за ними внутренней грудной артерией, веной и клетчаткой, в которой залегает цепочка парастер-нальных лимфатических узлов. Центральный и периферический концы внутренних грудной артерии и вены лигируют шелком. Резецированную пластинку грудной стенки шириной 4—5 см удаляют вместе с молочной железой. Образовавшийся дефект в грудной стенке укрывают лоскутом из большой грудной мышцы, широкой фасцией бедра или ксенопластическим протезом.
Некоторые данные о лекарственной терапии:
Источники эстрогенов в организме: основной – яичники.
Дополнительные – надпочечники, мышцы, печень, жировая ткань.
Антиэстрогены: Тамоксифен – 20мг/сут, не больше.
ОПУХОЛИ ПИЩЕВОДА
 2020-09-24
2020-09-24 147
147








