Оксид углерода (II) CO – угарный газ, при обычных условиях является газом без цвета и запаха, плохо растворимым в воде. Угарный газ очень ядовит, при высокой концентрации в атмосфере вызывает отравление и смерть. Угарный газ образуется при пожарах в процессе горения древесины и других органических материалов.
Угарный газ образуется при неполном горении углерода и органических веществ:
0 0 +2 -2
2С + О2 = 2СО
Угарный газ также можно получить при сжигании углерода в атмосфере углекислого газа СО2:
0 +4 -2 t +2 -2
С + СО2 = 2СО
Угарный газ СО является несолеобразующим оксидом, поэтому не реагирует с водой с образованием кислоты, не взаимодействует с основными оксидами и гидроксидами.
С точки зрения окислительно-восстановительных свойств СО является сильным восстановителем,
+2 -2 +2 -2 t 0 +4 -2
CuO + CO = Cu + CO2
+2 -2 0 +4 -2
2СО + О2 = 2СО2
При попадание в лёгкие СО связывает ионы железа в гемоглобине с образованием прочных комплексов, при этом теряется основная функция гемоглобина – перенос кислорода. Возникает кислородное голодание, которое сначала сопровождается сонливостью, потерей сознания, парализацией мышечной системы и остановкой сердца.
Оксид углерода (IV) CO2 – углекислый газ, при обычных условиях является газом без цвета и запаха, растворимым в воде, не токсичен, но при больших концентрациях в атмосфере может вызывать отравления.
Углекислый газ СО2 образуется при горении органических веществ в избытке кислорода:
-2 +1 0 +4 -2 +1 -2
С2Н4 + 3О2 = 2СО2 + 2Н2О
Получить углекислый газ также можно разложением солей карбонатов:
СаСО3 = СаО + СО2↑
СО2 является кислотным оксидом, поэтому взаимодействует с водой с образованием слабой угольной кислоты, которая способна разлагаться обратно до углекислого газа и воды:
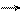
 CO2 + H2O H2CO3
CO2 + H2O H2CO3
Как кислотный оксид, СО2 хорошо реагирует с сильными основными оксидами и гидроксидами:
СО2 + SrO = SrCO3
СО2 + 2KOH = K2CO3 + H2O
Взаимодействие хлора со щелочами при нагревании и на холоде
Галогены реагируют с растворами щелочей, как правило, с образованием 2-х солей.
0 +1 -2 +1 холод +1 -1 +1 +1 -2 +1 -2
Cl2 + 2NaOH = NaCl + NaClO + H2O
0 +1 -2 +1 нагрев +1 -1 +1 +5 -2 +1 -2
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
 2020-09-24
2020-09-24 563
563








