
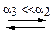
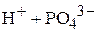 ,
,
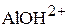
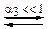
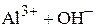 .
.
Представленные реакции являются, соответственно, второй и третьей ступенями диссоциации фосфорной кислоты  и третьей ступенью диссоциации гидроксида алюминия
и третьей ступенью диссоциации гидроксида алюминия 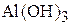 . Оба эти соединения относятся к слабым электролитам, они диссоциируют ступенчато, причём каждая следующая ступень диссоциации происходит в значительно меньшей степени.
. Оба эти соединения относятся к слабым электролитам, они диссоциируют ступенчато, причём каждая следующая ступень диссоциации происходит в значительно меньшей степени.
Пример 2. Определите константу диссоциации частицы  при 298 К, используя справочные термодинамические данные.
при 298 К, используя справочные термодинамические данные.
Решение. Константа равновесия процесса диссоциации электролита 

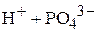
называется константой диссоциации:
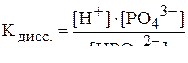 .
.
Константа диссоциации электролита может быть найдена на основе соотношения, связывающего стандартную энергию Гиббса процесса диссоциации электролита и константу диссоциации:
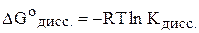 .
.
Стандартная энергия Гиббса диссоциации находится как разность стандартных энергий Гиббса ионов и недиссоциированного электролита. Обратите внимание, что стандартное состояние недиссоциированного электролита (в нашем случае  ) должно сопровождаться записью «р-р, ст. с., гип. недисс.». Это означает, что электролит находится в растворе со свойствами бесконечно разбавленного, но при этом на ионы не диссоциирует.
) должно сопровождаться записью «р-р, ст. с., гип. недисс.». Это означает, что электролит находится в растворе со свойствами бесконечно разбавленного, но при этом на ионы не диссоциирует.
Таким образом, термодинамическое уравнение диссоциации имеет вид:


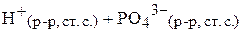 ,
,


 .
.
Найдём константу диссоциации
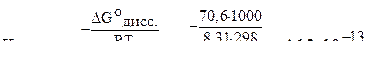 .
.
При решении задачи необходимо согласовать размерности  и R.
и R.
Напомним,  .
.
Пример 3. Определите концентрации ионов в 0,01 М растворе 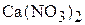 .
.
Решение. Диссоциация сильного электролита 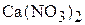 в разбавлен-ном растворе протекает полностью. Степень диссоциации равна 1.
в разбавлен-ном растворе протекает полностью. Степень диссоциации равна 1.
 .
.
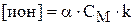 ,
,
где k – коэффициент перед ионом в уравнении диссоциации;
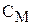 – молярная концентрация электролита.
– молярная концентрация электролита.
 ,
,
 .
.
Пример 4. Определите рН 0,1 мас.% раствора 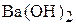 . Плотность раствора примите равной 1
. Плотность раствора примите равной 1  .
.
Решение. Гидроксид бария в разбавленном растворе диссоциирует нацело:
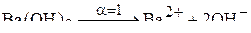 .
.
Раствор имеет щелочную среду, рН > 7. Водородный показатель рН определяется как отрицательный десятичный логарифм концентрации иона водорода:
 .
.
Аналогично,
 .
.
При 298 К
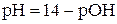 .
.
Концентрации ионов 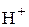 и
и 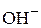 должны быть выражены в
должны быть выражены в 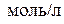 .
.
Найдём молярность раствора гидроксида бария. Пусть объём раствора равен 1000 мл (объём раствора можно принять равным любому числу, ответы не изменяться).
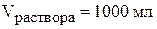 ,
,
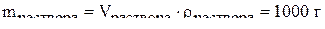 ,
,
 ,
,
 .
.
Поскольку объём раствора принят 1 л, то
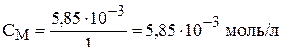 ,
,
 ,
,
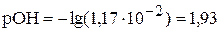 ,
,
 .
.
Пример 5. Определите степень диссоциации уксусной кислоты в 0,1 М водном растворе кислоты и рН этого раствора.  .
.
Решение. Уксусная кислота – слабый электролит, степень её диссоциации значительно меньше 1.
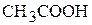

 ,
,
 .
.
Степень диссоциации α равна отношению распавшихся молекул электролита (а значит, образовавшихся ионов 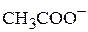 или
или 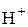 ) к исходному числу молекул электролита.
) к исходному числу молекул электролита.
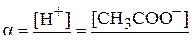 .
.
Равновесная концентрация уксусной кислоты равна исходной концентрации минус концентрация продиссоциированных молекул (а последняя, очевидно, равна концентрации образовавшихся ионов 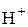 или
или 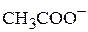 ):
):
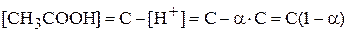 .
.
Подставим полученные выражения в формулу для константы диссоциации:
 .
.
Полученное выражение носит название закона разбавления Оствальда и представляет собой зависимость степени диссоциации от концентрации электролита: чем меньше концентрация, тем больше степень диссоциации электролита.
Поскольку часто 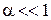 , то выражение упрощается
, то выражение упрощается  .
.
Найдём степень диссоциации
 .
.
Степень диссоциации 0,0134 или 1,34 % величина небольшая, поэтому наш приближённый расчёт справедлив.
Найдём рН раствора:
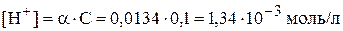 ,
,
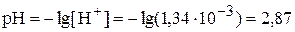 .
.
Возможен и второй способ решения задачи: сначала найти концентрацию иона водорода, а затем степень диссоциации. Поскольку при диссоциации уксусной кислоты 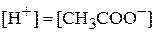 , запишем:
, запишем:
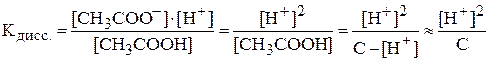 .
.
Тогда:
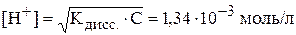 ,
,
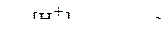 .
.
Пример 6. Какой объём 0,1 М раствора соляной кислоты надо добавить к 100 мл 0,1 М раствора уксусной кислоты ( ), чтобы степень диссоциации уксусной кислоты уменьшилась в 10 раз? При решении примите, что объём полученного раствора равен сумме объёмов исходных растворов.
), чтобы степень диссоциации уксусной кислоты уменьшилась в 10 раз? При решении примите, что объём полученного раствора равен сумме объёмов исходных растворов.
Решение. При добавлении к раствору слабого электролита (уксусная кислота) раствора сильного электролита (соляная кислота) диссоциация слабого электролита уменьшается в соответствии с принципом Ле Шателье.
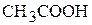

 ,
,
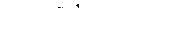 .
.
Степень диссоциации 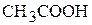 должна уменьшиться в 10 раз. Используя решение предыдущего примера:
должна уменьшиться в 10 раз. Используя решение предыдущего примера:
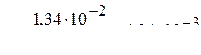 .
.
Пусть объём раствора 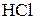 равен V. Тогда раствор, полученный после смешивания двух растворов (соляной кислоты и уксусной кислоты) будет иметь объём
равен V. Тогда раствор, полученный после смешивания двух растворов (соляной кислоты и уксусной кислоты) будет иметь объём 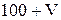 . Найдём концентрации кислот после смешивания растворов.
. Найдём концентрации кислот после смешивания растворов.
Запишем уравнение материального баланса:
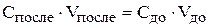 ,
,
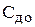 и
и 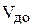 – концентрация и объём каждого раствора, соответственно, до смешивания растворов;
– концентрация и объём каждого раствора, соответственно, до смешивания растворов;
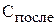 и
и 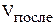 – концентрация веществ и объём полученного раствора, соответственно, после смешивания.
– концентрация веществ и объём полученного раствора, соответственно, после смешивания.
Для 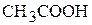 :
:
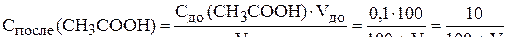 .
.
Для 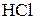 :
:
 .
.
Запишем выражение для константы диссоциации уксусной кислоты:
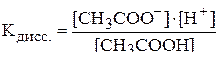 .
.
Концентрация иона водорода в полученном растворе равна:
 .
.
Уксусная кислота в присутствии сильного электролита диссоциирует незначительно, поэтому концентрация иона водорода в полученном растворе определится лишь концентрацией 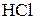 :
:
 .
.
Концентрация ацетат-иона связана с концентрацией уксусной кислоты через степень диссоциации:
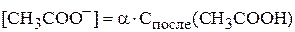 .
.
Поскольку уксусная кислота в присутствии сильного электролита диссоциирует незначительно, то
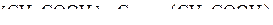 .
.
Подставим 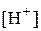 ,
,  и
и  в формулу для константы диссоциации:
в формулу для константы диссоциации:
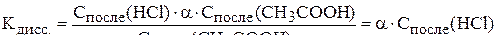 .
.
Подставим значения α и  в выражение для
в выражение для 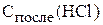
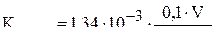 ,
,
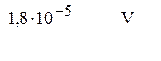 ,
,
 ,
,
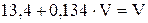 .
.
Отсюда  .
.
При добавлении 15,5 мл 0,1 М раствора 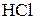 к 100 мл 0,1 М раствора уксусной кислоты степень диссоциации уксусной кислоты уменьшится в 10 раз.
к 100 мл 0,1 М раствора уксусной кислоты степень диссоциации уксусной кислоты уменьшится в 10 раз.
Вариант 1
1. Напишите уравнения диссоциации солей 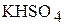 ,
, 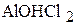 ,
, 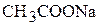 ,
, 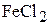 и образующихся частиц
и образующихся частиц  ,
, 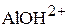 .
.
2. Определите константу диссоциации частицы  при 298 К, используя справочные термодинамические данные. (0,0104)
при 298 К, используя справочные термодинамические данные. (0,0104)
3. Определите концентрации ионов в 0,02 М растворе 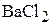 .
.
4. Определите рН 0,05 мас.% раствора азотной кислоты. Плотность раствора примите равной 1  . (2,10)
. (2,10)
5. 1 М раствор слабой одноосновной кислоты имеет рН = 4. Найти рН 0,1 М раствора этой кислоты. Какова степень диссоциации кислоты в 0,1 М растворе? (4,5; 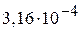 )
)
6. Какой объём 0,05 мас.% раствора азотной кислоты (плотность раствора равна 1  ) необходимо добавить к 100 мл 0,1 М раствора слабой одноосновной кислоты (см. условие задачи 5), чтобы степень диссоциации этой кислоты уменьшилась в 2 раза? При решении задачи примите, что объём полученного раствора равен сумме объёмов исходных растворов кислот. (8,66 мл)
) необходимо добавить к 100 мл 0,1 М раствора слабой одноосновной кислоты (см. условие задачи 5), чтобы степень диссоциации этой кислоты уменьшилась в 2 раза? При решении задачи примите, что объём полученного раствора равен сумме объёмов исходных растворов кислот. (8,66 мл)
Вариант 2
1. Напишите уравнения диссоциации солей 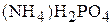 ,
, 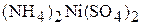 ,
, 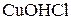 ,
, 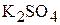 и образующихся частиц
и образующихся частиц  ,
, 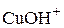 .
.
2. Определите константу диссоциации частицы  по первой ступени при 298 К, используя справочные термодинамические данные. (
по первой ступени при 298 К, используя справочные термодинамические данные. ( )
)
3. Определите концентрации ионов в 0,03 М растворе 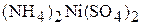 (гидролиз соли не учитывать).
(гидролиз соли не учитывать).
4. Определите рН раствора гидроксида натрия, титр которого равен 0,01 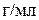 . (12,6)
. (12,6)
5. Вычислите рН раствора циановодородной кислоты и концентрацию раствора, если степень диссоциации HCN в растворе равна 0,1 %, а константа диссоциации HCN равна 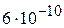 . (4,61;
. (4,61; 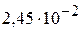 )
)
6. В каком соотношении необходимо смешать 0,01 М раствор HCl и раствор HCN (см. условие задачи 5), чтобы степень диссоциации HCN уменьшилась в 10 раз? При решении задачи примите, что объём полученного раствора равен сумме объёмов исходных растворов кислот. (1:1666)
Вариант 3
1. Напишите уравнения диссоциации солей 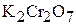 ,
,  ,
,  ,
, 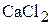 и образующихся частиц
и образующихся частиц 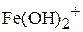 ,
,  .
.
2. Определите константу диссоциации угольной кислоты 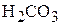 по первой ступени при 298 К, используя справочные термодинамические данные. (
по первой ступени при 298 К, используя справочные термодинамические данные. (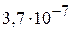 )
)
3. Определите концентрации ионов в 0,05 М растворе 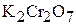 .
.
4. Определите рН раствора соляной кислоты, титр которого равен 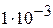
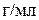 . (1,56)
. (1,56)
5. Вычислите рН раствора уксусной кислоты, полученного смешением 100 мл 0,1 М раствора 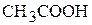 и 900 мл 0,01 М раствора
и 900 мл 0,01 М раствора 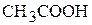 . Какова степень диссоциации уксусной кислоты в полученном растворе?
. Какова степень диссоциации уксусной кислоты в полученном растворе? 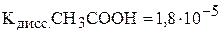 . Примите, что объём полученного раствора равен 1000 мл. (3,23; 3,07 %)
. Примите, что объём полученного раствора равен 1000 мл. (3,23; 3,07 %)
6. В 100 мл 0,1 М раствора уксусной кислоты ( ) растворили 0,01 М хлороводорода. Как изменится при этом степень диссоциации уксусной кислоты? При решении задачи примите, что объём полученного раствора равен 100 мл. (Уменьшится в 74,5 раз)
) растворили 0,01 М хлороводорода. Как изменится при этом степень диссоциации уксусной кислоты? При решении задачи примите, что объём полученного раствора равен 100 мл. (Уменьшится в 74,5 раз)
Вариант 4
1. Напишите уравнения диссоциации солей  ,
, 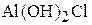 ,
, 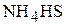 ,
, 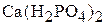 и образующихся частиц
и образующихся частиц 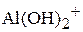 ,
,  .
.
2. Определите константу диссоциации фосфорной кислоты по первой ступени при 298 К, используя справочные термодинамические данные. (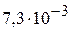 )
)
3. Определите концентрации ионов в 0,04 М растворе 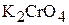 .
.
4. Вычислите рН раствора 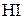 , 250 мл которого содержат 1,28 г
, 250 мл которого содержат 1,28 г 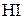 . (1,40)
. (1,40)
5. Вычислите рН раствора уксусной кислоты и концентрацию кислоты в растворе, если степень диссоциации 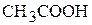 в растворе равна 1 %, а константа диссоциации
в растворе равна 1 %, а константа диссоциации 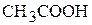 равна
равна  . (2,74; 0,18 М)
. (2,74; 0,18 М)
6. Как изменится степень диссоциации уксусной кислоты, если слить равные объёмы раствора 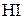 (см. условие задачи 4) и раствора
(см. условие задачи 4) и раствора 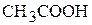 (см. условие задачи 5)? При решении задачи примите, что объём полученного раствора равен сумме объёмов исходных растворов кислот. (Уменьшится в 11,1 раз)
(см. условие задачи 5)? При решении задачи примите, что объём полученного раствора равен сумме объёмов исходных растворов кислот. (Уменьшится в 11,1 раз)
Вариант 5
1. Напишите уравнения диссоциации солей 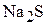 ,
,  ,
, 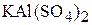 ,
,  и образующихся частиц
и образующихся частиц 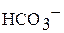 ,
,  .
.
2. Определите константу диссоциации частицы  при 298 К, используя справочные термодинамические данные. (
при 298 К, используя справочные термодинамические данные. (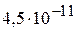 )
)
3. Определите концентрации ионов в 0,01 М растворе 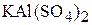 (гидролиз соли не учитывать).
(гидролиз соли не учитывать).
4. Вычислите рН раствора, полученного смешением равных объёмов 0,04 М раствора 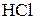 и 0,03 М раствора
и 0,03 М раствора 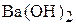 . (12)
. (12)
5. Определите степень диссоциации циановодородной кислоты в 0,2 М водном растворе кислоты и рН этого раствора. 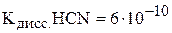 . (
. (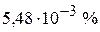 ; 4,96)
; 4,96)
6. Как изменится степень диссоциации циановодородной кислоты, если в 1 л раствора (см. условие задачи 5) добавить 1 г цианида натрия? Примите, что объём раствора не изменился. (Уменьшится в 1864 раза)
13. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ. БУФЕРНЫЕ РАСТВОРЫ
Пример 1. Определить:
а) равновесную молярную концентрацию катионов в насыщенном растворе фосфата аммония-магния, если величина  ;
;
б) равновесную молярную концентрацию аниона в насыщенном растворе ортоарсената меди(II), если величина  ;
;
в) растворимость (концентрацию насыщенного раствора в моль/л) хлорида свинца, если величина 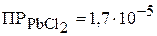 ;
;
г) рН насыщенного раствора гидроксида меди(II), если величина  ;
;
д) объём воды (в л), который необходим для растворения 2,00 г оксалата серебра, если величина  (объём воды принять равным объёму насыщенного раствора);
(объём воды принять равным объёму насыщенного раствора);
е) выпадает ли осадок карбоната кальция при смешении 100 мл насыщенного раствора сульфита кальция с 300 мл раствора карбоната натрия (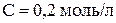 ), если
), если 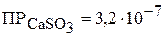 , а
, а 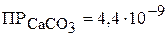 .
.
Все величины ПР приведены при 298 К.
Решение.
а) Пусть растворимость  в воде равна Р, моль/л. Тогда равновесные концентрации ионов в насыщенном растворе соли составят:
в воде равна Р, моль/л. Тогда равновесные концентрации ионов в насыщенном растворе соли составят:


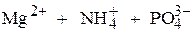
Р, моль/л Р, моль/л Р, моль/л Р, моль/л
 .
.
Следовательно, 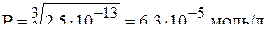 .
.
Таким образом, равновесные молярные концентрации катионов 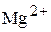 и
и 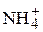 составляют:
составляют:
 .
.
б) Пусть растворимость 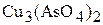 в воде равна Р, моль/л. Тогда равновесные концентрации ионов в насыщенном растворе соли составят:
в воде равна Р, моль/л. Тогда равновесные концентрации ионов в насыщенном растворе соли составят:
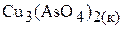

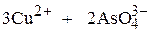
Р, моль/л 3Р, моль/л 2Р, моль/л

Следовательно, растворимость соли (молярная концентрация её насыщенного раствора)
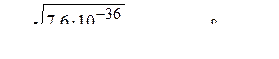 .
.
Молярная концентрация ортоарсенат-иона в насыщенном растворе составляет:
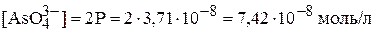 .
.
в) Пусть растворимость хлорида свинца в воде равна Р, моль/л. Тогда равновесные концентрации ионов в насыщенном растворе соли составят:



Р, моль/л Р, моль/л 2Р, моль/л
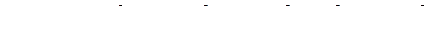 .
.
Следовательно, растворимость соли
 .
.
 2020-09-24
2020-09-24 209
209








