3. Вычислить при 298 К константу равновесия процесса
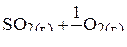

 ,
,
используя справочные данные о стандартных энтальпиях образования и стандартных энтропиях веществ:
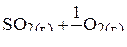


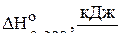 −296,9 0 −395,8
−296,9 0 −395,8
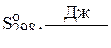 248,07 205,04 256,7
248,07 205,04 256,7
( )
)
4. В реакторе при некоторой температуре установилось равновесие


 .
.
Равновесные концентрации веществ 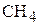 ,
, 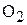 ,
, 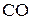 составили, соответственно, 0,06 моль/л, 0,04 моль/л, 0,05 моль/л. Вычислить начальные концентрации исходных веществ
составили, соответственно, 0,06 моль/л, 0,04 моль/л, 0,05 моль/л. Вычислить начальные концентрации исходных веществ 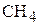 и
и 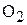 , если начальные концентрации продуктов
, если начальные концентрации продуктов 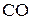 и
и 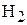 были равны 0 моль/л. (
были равны 0 моль/л. (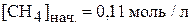 ;
; 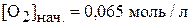 )
)
5. Вычислить при 298 К и давлении 101,325 кПа константу равновесия процесса
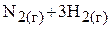

 ,
,
используя справочные данные о стандартных энтальпиях образования и стандартных энтропиях веществ:
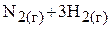


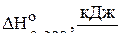 0 0 −46,2
0 0 −46,2
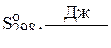 191,5 130,52 192,6
191,5 130,52 192,6
(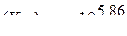 )
)
6. Вычислить константу равновесия 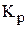 процесса
процесса
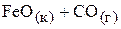

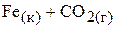
при 750 ºС и 101,325 кПа, если молярная доля 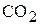 в равновесной газовой смеси равна 0,40. (
в равновесной газовой смеси равна 0,40. (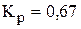 )
)
Вариант 2
1. Привести уравнения для вычисления констант равновесия 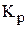 и
и 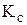 следующих процессов:
следующих процессов:
а) 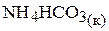

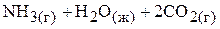 ;
;
б) 

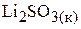 ;
;
в) 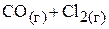

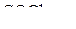 ;
;
г) 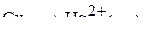

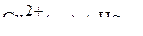 .
.
Для реакций, протекающих в газовой фазе, установить отношение между 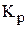 и
и 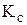 .
.
2. В сосуде объёмом 15 л содержалось 3,15 моль 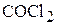 . При некоторой температуре в системе установилось равновесие
. При некоторой температуре в системе установилось равновесие
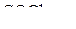

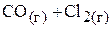 ,
,
при этом количество вещества 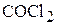 уменьшилось в 3 раза. Вычислить равновесные концентрации всех реагентов.
уменьшилось в 3 раза. Вычислить равновесные концентрации всех реагентов.
(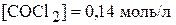 ;
; 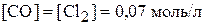 )
)
3. Используя справочные термодинамические данные, вычислить температуру, при которой давление кислорода, образующегося при термическом разложении оксида ртути(II), достигнет 101,325 кПа. (938 К)
4. При каком давлении в замкнутом сосуде установилось равновесие в системе
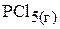

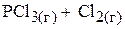 ,
,
если парциальное давление 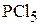 в состоянии равновесия стало равным 1 атм? Величина константы равновесия процесса при данной температуре
в состоянии равновесия стало равным 1 атм? Величина константы равновесия процесса при данной температуре 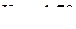 . (
. (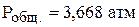 )
)
5. При 300 К и давлении 101,325 кПа степень диссоциации  по уравнению
по уравнению

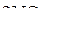
составляет 20 %. Вычислить величину константы равновесия  и величину
и величину  для указанного процесса. Считать, что начальное количество вещества
для указанного процесса. Считать, что начальное количество вещества  составляло 1 моль. (
составляло 1 моль. (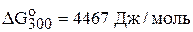 )
)
6. В сосуде объёмом 20 л вместе с катализатором содержится 126 г азота и 30 г водорода при 127 ºС. К моменту наступления химического равновесия 60 мол.% водорода прореагировало с образованием аммиака. Вычислить давление в сосуде в момент установления химического равновесия. (2243,7 кПа)
Вариант 3
1. Привести уравнения для вычисления констант равновесия 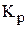 и
и 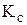 следующих процессов:
следующих процессов:
а) 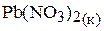
 ;
;
б) 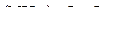
 ;
;
в) 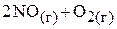

 ;
;
г) 

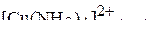 .
.
Для реакций, протекающих в газовой фазе, установить соответствие между 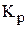 и
и 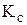 .
.
2. При некоторой температуре константа равновесия процесса
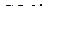

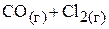 ,
,
равна 0,072. Вычислить равновесные концентрации оксида углерода(II) и хлора, если исходная концентрация фосгена составляла 0,32 моль/л, а исходные концентрации 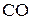 и
и  были равны 0 моль/л. (
были равны 0 моль/л. (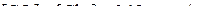 )
)
3. Вычислить средние значения величин 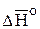 и
и  для процесса
для процесса


 ,
,
если давление насыщенного пара бромида олова(II) при 789 К и 909 К составляет соответственно 13,332 и 101,325 кПа. (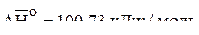 ;
;  )
)
4. При постоянном объёме и некоторой температуре в системе установилось равновесие
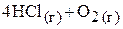

 .
.
Исходная смесь хлороводорода и кислорода имела относительную плотность по водороду, равную 16,9. Чему равно объёмное соотношение между реагентами в состоянии равновесия, если после его достижения выход хлора составляет 50 % от теоретического?
(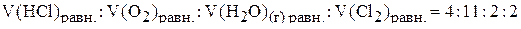 )
)
5. При 500 К константа равновесия реакции 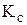
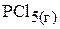

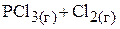
равна 0,04. В сосуд ёмкостью 5 л было введено 0,2 моль 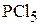 и 0,1 моль
и 0,1 моль 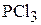 . Вычислить:
. Вычислить:
а) равновесный состав смеси;
б) общее давление в сосуде в состоянии равновесия;
в) равновесные парциальные давления компонентов в смеси.
( ;
; 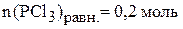 ;
;  ;
;
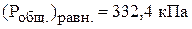 ;
;  ;
; 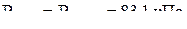 ).
).
6. При 333 К и давлении 35,46 кПа степень диссоциации  по уравнению
по уравнению


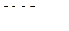
составляет 60 %. Вычислить величину константы равновесия 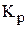 данного процесса, если начальное количество вещества
данного процесса, если начальное количество вещества  составляло 1 моль. (
составляло 1 моль. (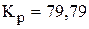 )
)
Вариант 4
1. Привести уравнения для вычисления констант равновесия 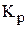 и
и 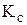 следующих процессов:
следующих процессов:
а) 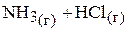

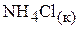 ;
;
б) 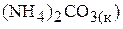

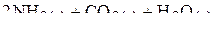 ;
;
в) 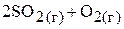

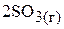 ;
;
г) 

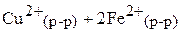 .
.
Для реакций, протекающих в газовой фазе, установить соответствие между 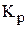 и
и 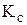 .
.
2. В замкнутой системе при некоторой температуре установилось равновесие
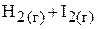

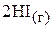 ,
,
при этом количество вещества иода уменьшилось в 4 раза, а объёмная доля иодоводорода составила 60 %. Вычислить объёмные доли водорода и иода в исходной смеси. (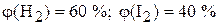 )
)
3.Вычислить при 298 К константу равновесия процесса


 ,
,
используя справочные данные о стандартных энтальпиях образования и стандартных энтропиях веществ. Предполагая, что величины 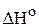 и
и 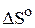 процесса не зависят от температуры, вычислить константу равновесия реакции при 373 К. (
процесса не зависят от температуры, вычислить константу равновесия реакции при 373 К. (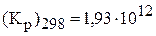 ;
; 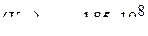 ).
).
4. При некоторой температуре исходные концентрации 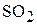 ,
, 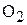 и
и 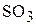 составили соответственно 0,1; 0,06 и 0,02 моль/л. После установления химического равновесия в системе
составили соответственно 0,1; 0,06 и 0,02 моль/л. После установления химического равновесия в системе
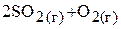

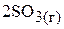
80 мол.% 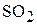 прореагировало. Вычислить равновесные концентрации реагентов и константу равновесия рассматриваемого процесса. (
прореагировало. Вычислить равновесные концентрации реагентов и константу равновесия рассматриваемого процесса. ( ;
; 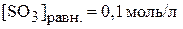 ; К = 1250)
; К = 1250)
5.Вычислить константу равновесия процесса
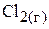

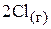
при 1200 К и давлении 101,325 кПа, используя справочные данные о стандартных энтальпиях образования и стандартных энтропиях веществ. Вычислить также степень диссоциации α молекулярного хлора на атомы при этих условиях, а также определить температуру, при которой константа равновесия процесса равна единице. В вычислениях пренебречь температурной зависимостью величин  и
и  .
.
(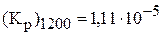 ; α = 0,449; T = 2264 К).
; α = 0,449; T = 2264 К).
6. Константа равновесия процесса
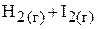

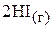
при некоторой температуре равна 60. Какое количество вещества иода необходимо взять на 1,5 моль водорода, чтобы 80 мол.% последнего превратить в 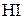 ? Считать, что процесс проходил в сосуде объёмом 1 л. (1,52 моль)
? Считать, что процесс проходил в сосуде объёмом 1 л. (1,52 моль)
Вариант 5
1. Привести уравнения для вычисления констант равновесия 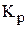 и
и 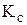 следующих процессов:
следующих процессов:
а) 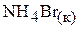

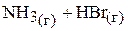 ;
;
б) 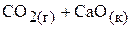

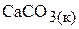 ;
;
в) 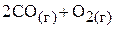

 ;
;
г) 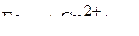

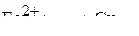 .
.
Для реакций, протекающих в газовой фазе, установить соответствие между 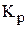 и
и 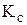 .
.
2. При некоторой температуре равновесная концентрация 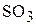 в системе
в системе
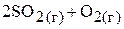

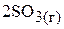
оказалась равной 0,04 моль/л, при этом 40 мол.% 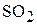 превратилось в
превратилось в 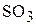 . Вычислить константу равновесия процесса и исходную концентрацию
. Вычислить константу равновесия процесса и исходную концентрацию 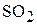 , если исходная концентрация
, если исходная концентрация 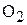 составила 0,2 моль/л. (К = 2,47;
составила 0,2 моль/л. (К = 2,47; 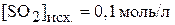 ).
).
3. Газовая смесь, содержащая 49 об.% 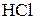 и 51 об.%
и 51 об.% 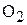 , была нагрета при постоянном давлении 96,39 кПа до 750 К. При достижении химического равновесия 76 об.%
, была нагрета при постоянном давлении 96,39 кПа до 750 К. При достижении химического равновесия 76 об.% 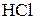 вступило в реакцию согласно уравнению
вступило в реакцию согласно уравнению
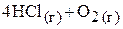

 .
.
Вычислить величину 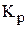 для данного процесса при 750 К. (
для данного процесса при 750 К. (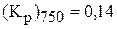 )
)
4. При каком начальном давлении фосгена степень его разложения α по уравнению
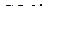

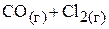
составляет 50 %, если при давлении 101,325 кПа величина  ? (
? ( )
)
5. Вычислить равновесный выход продуктов реакции
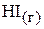

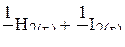 ,
,
при 400 К и 101,325 кПа. Считать, что величины 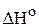 и
и 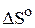 процесса не зависят от температуры. В расчётах использовать справочные данные о стандартных энтальпиях образования и энтропиях веществ. Принять, что начальное количество вещества
процесса не зависят от температуры. В расчётах использовать справочные данные о стандартных энтальпиях образования и энтропиях веществ. Принять, что начальное количество вещества 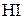 составляло 1 моль. (
составляло 1 моль. (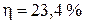 )
)
6. Химическое равновесие процесса
 +
+ 

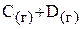
установилось при следующих концентрациях компонентов: 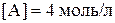 ;
; 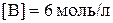 ;
; 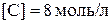 ;
; 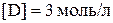 . В полученную равновесную систему добавили вещество В, увеличив его концентрацию на 4 моль/л. Вычислить новые равновесные концентрации веществ (считать, что температура и объём реакционной смеси не изменились).
. В полученную равновесную систему добавили вещество В, увеличив его концентрацию на 4 моль/л. Вычислить новые равновесные концентрации веществ (считать, что температура и объём реакционной смеси не изменились).
(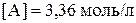 ;
; 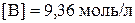 ;
; 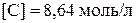 ;
; 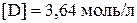 )
)
12. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Пример 1. Напишите уравнения диссоциации солей  ,
, 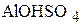 ,
, 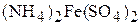 ,
, 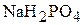 и образующихся частиц
и образующихся частиц 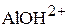 ,
,  .
.
Решение. Соли (за небольшим исключением, рассматриваемом во втором семестре) относят к сильным электролитам. В разбавленных растворах они диссоциированы нацело на катион и анион.
или
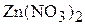


Обе записи правильны и встречаются в учебной и научной литературе (в дальнейшем будем придерживаться первого варианта записи).
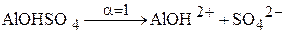 ,
,
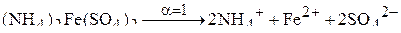 .
.
Сульфат железа и аммония – это двойная соль, диссоциирует также как и две составляющие её соли по отдельности.
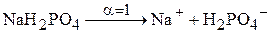 .
.
При диссоциации кислой соли (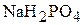 ) и основной соли (
) и основной соли (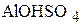 ) образуются ионы (
) образуются ионы ( и
и 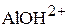 ), которые могут также диссоциировать. Однако их степень диссоциации α будет незначительна.
), которые могут также диссоциировать. Однако их степень диссоциации α будет незначительна.

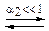
 ,
,
 2020-09-24
2020-09-24 494
494








